两款减肥大药,杀进千亿心血管市场
更新时间:
2025-09-07 08:06:45.221
在肥胖与糖尿病药物的商业竞逐中,semaglutide与tirzepatide的对抗常常被简化为“谁减重更快、谁市场更大”。
但ESC 2025(2025 年欧洲心脏病学会年会)让这场较量进入了新的维度——心血管结局。相比体重秤上的数字,心梗、中风、心衰这些核心领域,才是真正决定患者生命与支付方价值判断的指标。
ESC 2025公布的三组关键研究,从真实世界到事后分析,从二级预防到一级预防,再到心衰合并代谢表型,勾勒出一幅更为复杂的图景:已有心血管病患者的真实世界研究中,semaglutide显示出更明确的心血管事件风险降低;一级预防的人群中,tirzepatide则带来更大的十年心血管风险下降;而HfpEF(射血分数保留型心力衰竭)这一新兴领域,两者则并驾齐驱。
这不仅是两款药物的对比,更是对“心血管—代谢”交汇地带未来路径的一次集体评判。双方在代谢疾病和肝病领域之外的第三战场,再次给行业呈现出一派“梅须逊雪三分白,雪却输梅一段香”的健康竞争场景。
TONACEA
心血管病患者的比较试验:semaglutide领先tirzepatide
此次ESC 2025会场,最引人瞩目的无疑是诺和诺德的STEER研究(表1)。
这是一项规模庞大的真实世界回顾性研究,共纳入来自美国医疗理赔数据库的21250名受试者,按照处方记录与基线特征匹配后分为两组:一组接受semaglutide 2.4 mg,另一组接受tirzepatide。所有入组者均为超重或肥胖且已确诊动脉粥样硬化性心血管疾病,但没有糖尿病病史。
这一人群的选择与此前的随机对照研究有所呼应,目标是观察GLP-1类药物在非糖尿病但已确诊心血管病的肥胖患者中的价值。
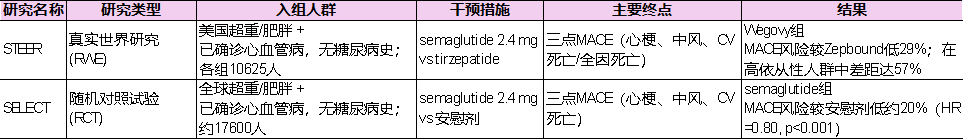
随访时间约为8.3个月(Wegovy组)和8.6个月(Zepbound组),主要观察指标为修订三点 MACE(心肌梗死、卒中、全因死亡)。
结果显示,在所有接受治疗的患者中,semaglutide组的MACE风险较tirzepatide组降低29%,相对优势已经相当明显。
而当研究者进一步限定在“高依从性人群”(即治疗期间未出现超过30天的用药间断)时,差距被显著放大:semaglutide带来的事件风险降低幅度比tirzepatide高出57%。这一差异体现在具体事件数量上同样清晰:Wegovy组共记录56例MACE事件,占比0.5%;Zepbound组为83例,占比0.8%。
这种趋势使研究团队提出了一个重要观点:心血管获益不能简单被视为GLP-1或GIP/GLP-1类药物的“类效应”,而可能与具体分子结构与作用机制密切相关。 诺和诺德方面也在会后解读时强调,semaglutide的心血管获益可能具有一定的分子特异性。
值得注意的是,这一真实世界结果与更早公布的SELECT随机对照研究形成了互证(表1)。SELECT试验同样聚焦在无糖尿病但有动脉粥样硬化性心血管病的超重或肥胖成人,结果显示semaglutide 2.4 mg相较安慰剂显著降低MACE风险约20%。
不同于随机对照试验的严格入组和严密管理,STEER研究在真实医疗环境下依旧观察到风险差异,说明这一结论具备较好的外部效度。尤其是在依从性分层分析中,效果量被显著放大,更加凸显了临床实践中“长期坚持用药”的关键意义。
换句话说,ESC 2025上的STEER不仅仅是在比较两种药物,更是在提醒医生和决策者:当GLP-1类药物被应用于真实世界的高危人群时,分子之间的差异、依从性管理的差异,都会直接转化为事件层面的差异。
这也解释了为什么semaglutide在这类二级预防人群(已经发生过心血管疾病,如心肌梗死、卒中、外周动脉疾病,或已经确诊动脉粥样硬化性心血管病的患者)中展现出独特优势。
TONACEA
一级预防的视角:tirzepatide在长期风险改善中的领先地位
若把焦点从“已经发生事件的患者”转向“尚未发病但风险堆积的人群”,比较的逻辑便发生了转变。
ESC 2025 公布了的SURMOUNT-5 事后分析(表2),这是礼来发起的一项临床试验(注册号 NCT05822830),属于其 SURMOUNT 项目的一部分,主要评估 tirzepatide与 semaglutide在肥胖人群中的疗效与安全性,它纳入了肥胖但无2型糖尿病、也无既往心血管事件史的成人,这正是典型的一级预防人群。
研究者采用 Framingham 十年心血管风险评分,并特别基于 BMI 进行校正,以模拟这一类人群在长期随访中的潜在风险走势。

在完成72周治疗的受试者中,结果显示 tirzepatide 对心血管风险的降低幅度显著优于 semaglutide。总体风险下降分别为 2.4% 与 1.4%(绝对分值,p<0.001),且在最大耐受剂量的比较中,这一差距进一步拉大:tirzepatide 可带来 23.7% 的十年心血管风险下降,而 semaglutide 为 13.6%(p<0.001)。值得注意的是,这两条曲线在第12周就已明显分离,说明药物在早期便能对危险因子产生持续作用。
更进一步的分解分析表明,tirzepatide 在多项危险因子的改善上表现出一致优势,包括体重指数(BMI)、收缩压、低密度脂蛋白胆固醇(LDL-C)、糖化血红蛋白(HbA1c)以及是否合并高血压状态。换句话说,它不仅通过减重,还通过血压、血脂、血糖的综合改善来降低整体心血管风险。
研究团队还进行了人群层面的模型外推:如果将这种风险下降推广至美国和欧洲五国的治疗可及人群,未来十年内理论上可以避免超过 310 万例一级心血管事件。这一预测数字虽然充满吸引力,但必须强调,它源自风险模型和假设性暴露情景,而非事件驱动的真实数据。
因此,这类分析更适合作为公共卫生层面与支付方决策的参考,回答的是“应该更早、更系统性地在何种人群中用药”,而不是“此刻谁一定能在事件层面更优”。换句话说,它描绘的是长期风险版图的位移,而非即时事件的差值。
TONACEA
HFpEF的第三块拼图:GLP-1通路在代谢性心衰中的突破
近年来,心衰射血分数保留型(HFpEF)逐渐成为心血管学界讨论的焦点。这类患者的左心室收缩功能尚可,但舒张功能受损,射血分数(LVEF)通常 ≥50%。
与传统射血分数降低型心衰(HFrEF)不同,HFpEF 患者往往伴随肥胖、2型糖尿病、高血压或代谢综合征,其发病机制更偏向代谢异常、慢性炎症和心脏结构僵硬化。
长期以来,HFpEF 一直是“药物荒漠”,主流的β受体阻滞剂、ACEI/ARB或ARNI等在这一人群中疗效有限,直到SGLT2抑制剂问世才逐渐打开局面。

ESC 2025 上公布的一项真实世界研究,正是针对这一代谢-心血管交汇点进行分析(表3)。
研究纳入了大规模的临床处方数据:semaglutide组约58333例,tirzepatide组约11257例,以DPP-4抑制剂sitagliptin作为参照。
在这一比较中,无论是semaglutide还是tirzepatide,都能显著降低“因心衰住院或全因死亡”的复合终点风险,幅度均超过40%。更值得注意的是,两者的头对头比较未显示出显著差异(HR=0.86,95%CI 0.70–1.06),提示它们在HFpEF人群中的临床获益大体相当。
安全性方面,研究没有观察到明显的不良事件增加,两药在大样本真实世界人群中的耐受性表现与既往糖尿病和肥胖研究保持一致。这对于HFpEF领域尤为重要,因为患者常常合并多种慢病,安全性考量是决定能否大规模推广应用的关键。
从机制角度看,GLP-1通路的介入为HFpEF带来了新的可能。它既能通过体重下降、血压和血糖改善减轻心脏负荷,又可能通过抗炎、改善血管功能和减少心外膜脂肪沉积来改变疾病进程。这种“多通路综合干预”恰恰契合了HFpEF复杂的病理生理基础。对比传统药物的有限疗效,这类代谢药物的进入被认为是HFpEF领域的一次“换道超车”。
这组结果已经在 JAMA 同步发表,并由 独立研究者 Nils Kruger 医学博士 在 ESC 2025 大会上报告。对于一个长期缺乏创新治疗的心衰亚型来说,这不仅是RWE的补充,更可能是未来临床实践转折点的重要信号。
TONACEA
Semaglutide vs. Tirzepatide为心血管疾病管理带来的启示
把这三类证据放在一起,争议的焦点自然指向两个纬度。
其一是人群差异。
已有动脉粥样硬化性心血管病的“二级预防”,与尚无事件但重度代谢异常的“一级预防”,药物的“护心轨迹”可能不同。二级预防更看重对已存在斑块与炎症-血小板轴的影响与事件级终点的即时改变;一级预防则强调体重、血压、脂质、糖代谢等多危险因子的同步拉直,体现在十年风险的连续下降。
其二是证据形态。
真实世界研究更敏感于依从性、药物暴露与临床路径的差异,比如STEER中“>30天不断药”的分层就明显放大了效应值;而基于风险模型的post-hoc外推,能更早揭示总体风险结构的不同,但距离“事件证据”仍有一段方法学上的可验证空间。
对临床与支付者而言,两种证据并不对立,它们回答的是不同的决策问题:前者更贴近当下“给谁用、能少多少事件”;后者提示未来“给得更广、更久,系统性风险能降到什么程度”。
机制层面也有值得审视的线索。
Tirzepatide在体重、腰围与代谢指标上的“广谱优势”,为一级预防的风险优化提供了更大的“底盘”,这与其GIP/GLP-1双通路对能量代谢与脂肪分布的影响吻合;相对地,semaglutide在二级预防“硬事件”的真实世界表现,叠加SELECT所见的MACE下降,提示GLP-1本身在抗炎、抗动脉粥样硬化进展、内皮功能改善与抗血小板活化等方面可能存在更直接的心血管保护信号。
两者在HFpEF领域“不分伯仲”,也从侧面说明在以肥胖-胰岛素抵抗-系统性炎症为主导的心衰表型里,减重与代谢重构或许才是主效应,药物之间的差距被“共同通路”所稀释。
未来若要进一步拆解分子间差异,需要跨越代理终点、进入前瞻的事件型比较,并在影像与多组学层面对斑块活性、脂肪器官轴、心外膜脂肪与微血管炎症进行更细粒度测量。
对临床路径的影响,已经可以做出相对稳健的归纳。
对于既往已发生ASCVD事件的高危肥胖人群,semaglutide的真实世界“事件证据”与既有RCT叠加,更容易推动指南与支付向“心血管风险指示”的适应症靠拢;而在未发病但风险堆叠的一级预防人群,tirzepatide凭借更强的体重与多危险因子校正幅度,具备构建“代谢-多因素风险降幅”叙事的优势,这会优先影响雇主-商业险与体重管理计划的处方策略,并催化更早、更系统的干预。
对HFpEF合并肥胖,两药都已跨过“是否有效”的门槛,接下来是与SGLT2抑制剂等标准治疗的序贯/合并路径、真实世界长期安全性与生活质量终点的整合,以及对“心脏-肾脏-代谢”三元复合风险的联动管理。
还需给这波“护心之争”加上两句冷静的脚注。
第一,证据等级与适应症外推要分层看。STEER是回顾性观察,易受处方偏倚、依从性差异与残余混杂影响;SURMOUNT-5是post-hoc且基于风险模型,推演到“可避免事件数”本质是政策与公共卫生层面的情景估算;HFpEF研究则尽管基于大样本RWE并在顶级期刊发布,但仍需前瞻型、事件驱动的头对头验证来固化定位。
第二,长期生态变量正在重写比较基线:口服剂型(orforglipron、口服semaglutide)的可及性、持续供给能力与价格机制、以及各地对肥胖和心血管风险管理的支付改革,都可能让当下的“相对优势”在不同市场呈现不同显影。这也意味着,从企业到医生的策略,都应当尊重人群差异与终点差异,在合适的人、合适的时间、用合适的证据做合适的事。
TONACEA
护心之争,受益的应是患者
ESC 2025 三组研究带来的不是一个非此即彼的答案,而是一幅层次分明的证据图景:在二级预防人群中,semaglutide提供了更坚实的事件级证据;在一级预防人群中,tirzepatide展现了更强的长期风险下降;在HFpEF这一代谢-心血管交汇点上,两者则并驾齐驱。
这场“护心之争”,在科学层面是分子机制与人群选择的较量,在市场层面是两大巨头的正面交锋。但从医疗价值的角度,它真正的意义在于推动 GLP-1 类药物从减重走向心血管保护,让不同人群都有机会获益。
未来,不论哪一方在某个场景中占据优势,只要竞争能够驱动证据积累、适应症拓展和支付体系的完善,那么最终受益的,应该是最需要保护的患者群体。
上一页
下一页
相关新闻





