干细胞药物产业化之路,如何跨越临床研究“死亡之谷”
更新时间:
2025-07-07 09:28:32.152
近年来,国家高度重视干细胞技术在生命科学领域的突破性进展,出台了一系列政策,旨在加速干细胞研究的创新与成果转化,推动其在临床治疗、药物研发及再生医学等领域的广泛应用。
应同写意邀请,南方科技大学健康医学研究院李富荣教授在“2025博鳌细胞疗法创新与转化应用大会暨细胞基因技术转化应用政策研讨会”上分享了题为《干细胞药物产业化之路,如何跨越临床研究“死亡之谷》报告。本文系根据报告内容整理。

李富荣
南方科技大学健康医学研究院教授
TONACEA
全球干细胞药物临床研究现状与挑战
国家对细胞治疗产品(CTMPs)的定义,是指用于治疗人类疾病、来源及操作符合伦理要求、经体外操作(如分离、培养、扩增、基因修饰)制备的人源活细胞产品。包括干细胞、未经或经基因修饰的免疫细胞(如CAR-T, CAR-NK)等,通过再生、替代或免疫调节发挥疗效。
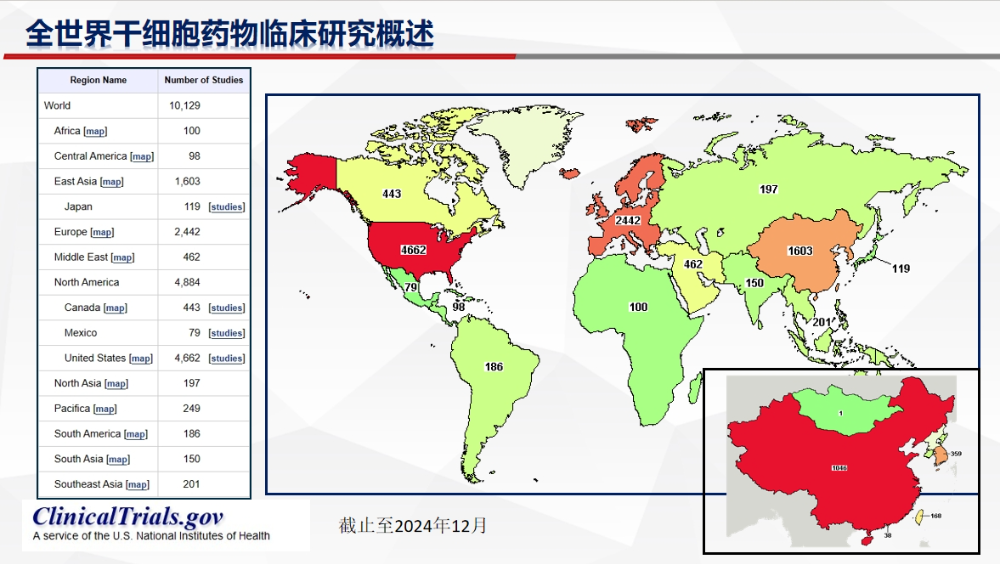
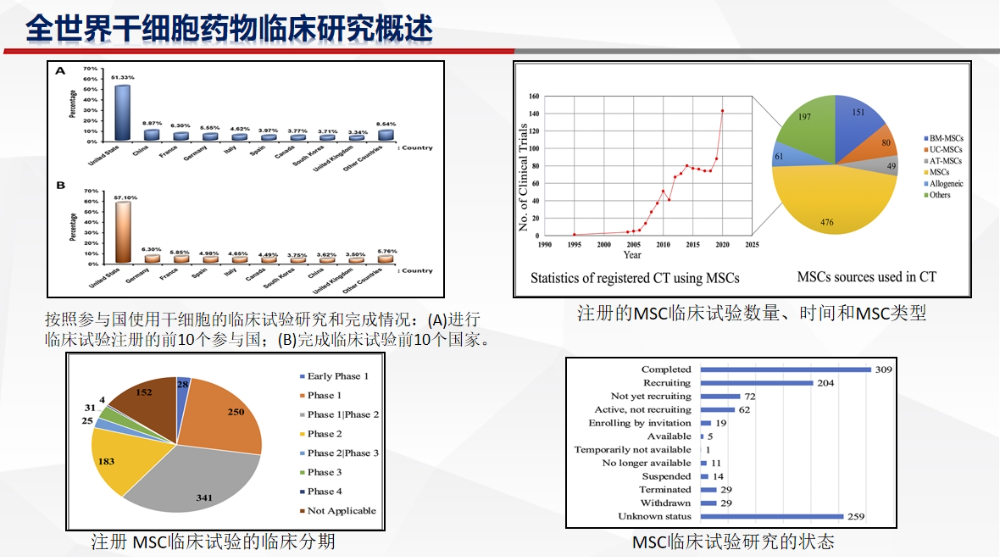
我们先来回顾一下全球干细胞临床研究情况,全球注册干细胞临床研究项目已超万个,中国亦超千项。虽然整体数量增长迅猛,但从临床试验分期来看,中国细胞与基因产业(CGT)领域仍处于初步探索阶段,I期临床试验占比高达56.5%,仍以安全性和初步疗效为主;II期试验占比不足10%,III期更是稀少,仅占5.2%。
截至2024年12月,完成中国干细胞药物申报情况,59家企业的146款干细胞药物获CDE受理,1款干细胞药物获批上市,仅5家公司的5款药物进入III期临床试验。
中国IND干细胞药物特点,细胞来源主要以间充质干细胞(MSCs)为主,脐带来源MSCs(78%),脂肪来源MSCs(9%),骨髓来源MSCs(7%),其他(胎盘、羊膜、宫血、牙髓)(6%)。适应症分布:呼吸系统疾病15项 (22%),骨关节系统疾病12项(17%),免疫系统疾病12项(17%)。

干细胞作为药物必要要有药效学功能。干细胞具备药效学功能。第一个是诱导定向分化,干细胞可在人体的微环境下向不同的方向分化,以补充、替代受损、病变和衰老的组织细胞从而恢复各系统、器官的功能。
第二是免疫调节功能,间充质干细胞对免疫系统具有双向调节作用,对于免疫功能过高者,可降低免疫力,缓解自身免疫性疾病症状;而对免疫功能过低者,则可促进免疫细胞分裂,提升人体免疫力。
第三是旁分泌作用,间充质干细胞通过分泌大量生物活性因子来调节局部微环境、促进组织修复、抑制炎症反应,激活宿主内源性干细胞,修复细胞损伤、促进细胞生长,恢复细胞的正常生理功能。
TONACEA
制约产业化的关键因素
尽管诸多实验室,都曾发布自己在干细胞领域的临床研究成果,而事实上,多数发表在顶级刊物上研究成果却难以在临床试验中重现。我们排除试剂、设备、操作等方面的客观因素,单单间充质干细胞作为药品的主体,不同供体、不同组织来源的MSCs生物学效能存在差异,导致临床试验结果难以重复和标准化。不同个体来源的组织间充质干细胞的生物效能不同,导致临床试验治疗效果存在较大的差异;
与此同时,间充质干细胞的输注剂量、给药途径和频率各异,导致的治疗效果差异较大。干细胞作为活体药物,其细胞活性程度、制备过程中细胞的动态变化,作用机制复杂性,体内监测难等特点导致其研发、质量控制困难,导致研发和质量控制难度陡增。均是影响干细胞产业化的重要影响因素。
另外,干细胞药物与现有化药成药性评价体系不同,各企业需要建立干细胞药物生产工艺质量技术体系和管理体系,筛选生物效能评价指标,生产工艺中3D培养体系的建立,以及全自动化全封闭式细胞智能制造路径,也是影响干细胞产品研发的重要难题。
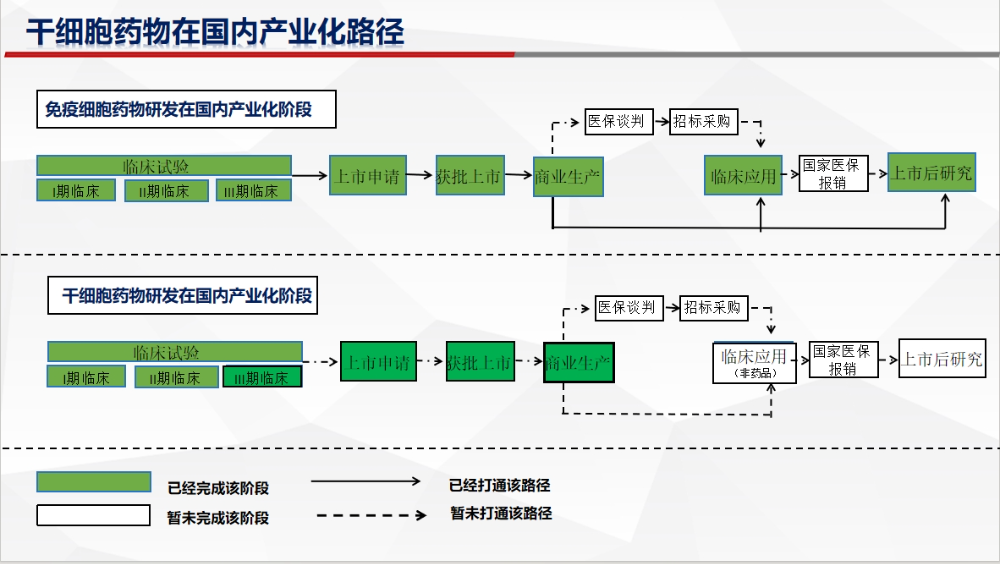
中国干细胞新药的技术迭代正面临“应用稳中求进”与“创新险中求胜”的双重挑战。当前以间充质干细胞为主的研发策略虽能快速填补市场空白,但需警惕技术代际断层的风险。未来需通过需政策引导、资本支持和技术攻关协同,构建多层次研发体系,实现从“跟跑”到“并跑”的跨越。
TONACEA
干细胞产业破局新范式
不同供体不同组织来源的干细胞差异,以及不同制备批次间差异,直接影响治疗稳定性。未来需要基因编辑技术(如CRISPR-Cas9),通过iPSC诱导分化建立覆盖中国人群的通用型间充质干细胞,解决不同共体来源的异质性问题,实现批量生产“现货型”细胞治疗产品。
在生产环节,实现AI辅助下的全自动封闭式制备系统,突破现有对传统经验依赖,解决质量不均与成本高昂问题。依据药品针对的适应症,需要筛选与建立生物效能检测指标与方法,使其具有靶向性和药效性。同时需要解决干细胞药物在4度下储存时间和运输过程中的稳定性问题,延长药物的有效期,提高药物的可及性。
从干细胞药物监管层面上来说,早期,干细胞与免疫细胞治疗领域处于探索阶段,相关法规政策并不明确,存在诸多争议。近些年来国家药监局陆续发布了一系列相关指导原则,对干细胞与免疫细胞新药的研发、生产、临床试验、审评审批等各个环节都提出了明确要求和规范。
这些法规政策的出台,为干细胞与免疫细胞新药的研发和上市提供了重要的法律依据和规范标准,引导行业从无序走向有序。然而,由于这一领域发展迅速,新技术、新方法不断涌现,法规政策也需要不断更新和完善,以适应行业发展的需求。
今年3月,海南博鳌乐城的“先行先试”政策权限就实现了监管创新。第二届博鳌乐城干细胞大会首次公布了中国干细胞行业价格收费标准、准入标准以及首批获准收费项目清单。
— 总结 —
据统计,在全球已上市干细胞药物中,约80%为间充质干细胞产品。中国这几年是爆发性增长,2024年中国受理的干细胞新药就有23款,其中18项为间充质干细胞。
当下大部分已获批上市的间充质类细胞产品,主要是根据其免疫调控和旁分泌作用来选择适应症,如自身免疫性疾病、退行性疾病和运动损伤等疾病。市场定价基本都在每剂几万到十几万美金不等,费用极其昂贵,已上市产品的市场销售情况尚不乐观。
随着中国第一款干细胞药物正式上市,标志着中国正式迈入临床应用的新阶段。艾米迈托赛注射液的单次注射价格为19800元(规格12mL,含6×10^7个细胞),相较于国外同类产品动辄数十万美元的高昂价格,这一定价无疑为国内患者带来了福音。谁将率先完成III期临床试验,获得确证性疗效数据,并成功实现商业化落地,是产业最核心的期待。
随着技术瓶颈的突破、监管体系的完善和生产能力的提升,未来高质量、可负担的干细胞药物将不再遥不可及。更多患者将有望受益于干细胞治疗的神奇效果,解除病痛困扰。
上一页
相关新闻





