抗体与Car-T,免疫治疗“双子星”的双向奔赴
更新时间:
2025-07-16 09:05:57.203

不过,这两大明星疗法并非各自为营,而是正经历着一场深刻的“双向奔赴”:抗体在不断“CAR-T化”,通过多靶点设计和精巧的机制,力图实现CAR-T般的深度缓解;而CAR-T则在积极“抗体化”,从异体型到体内型,以期达到抗体般的通用性和可及性。
这场技术的改革与创新,正以前所未有的速度,重塑着免疫治疗的未来图景。
TONACEA
抗体的“CAR-T化”
100%的ORR触手可及
传统单抗虽能够精准靶向单一抗原,却常因肿瘤的复杂异质性而力不从心。近年来,随着抗体技术的不断进展,多靶点抗体的优势日益凸显,从双抗到多抗,研发和治疗正朝着“1+1≥2”理想场景迈进。
T细胞衔接器抗体(TCE)是双抗技术的一次革命。TCE的一端牢牢抓住肿瘤细胞表面的肿瘤抗原,另一端则精准地“牵引”患者自身的T细胞靠近癌细胞,促使T细胞识别并启动对癌细胞的杀伤。
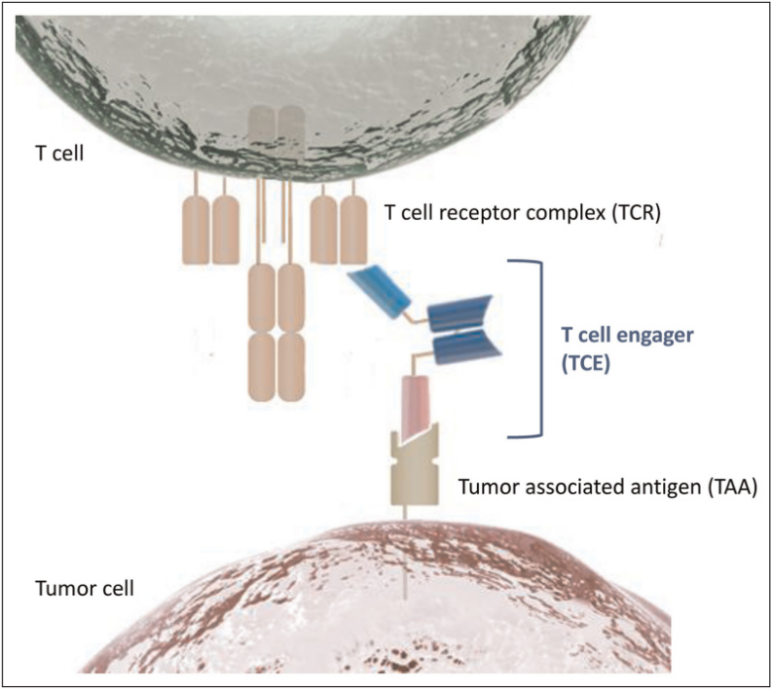
这种机制与CAR-T细胞杀伤肿瘤的原理异曲同工,利用自身T细胞强大的免疫效应,在一些适应症中,TCE甚至能展现出与CAR-T疗法相近的缓解率。
然而,抗体的疗效仍有很大的上升空间,多特异性抗体(三抗、四抗)的开发正将多靶点策略推向极致。
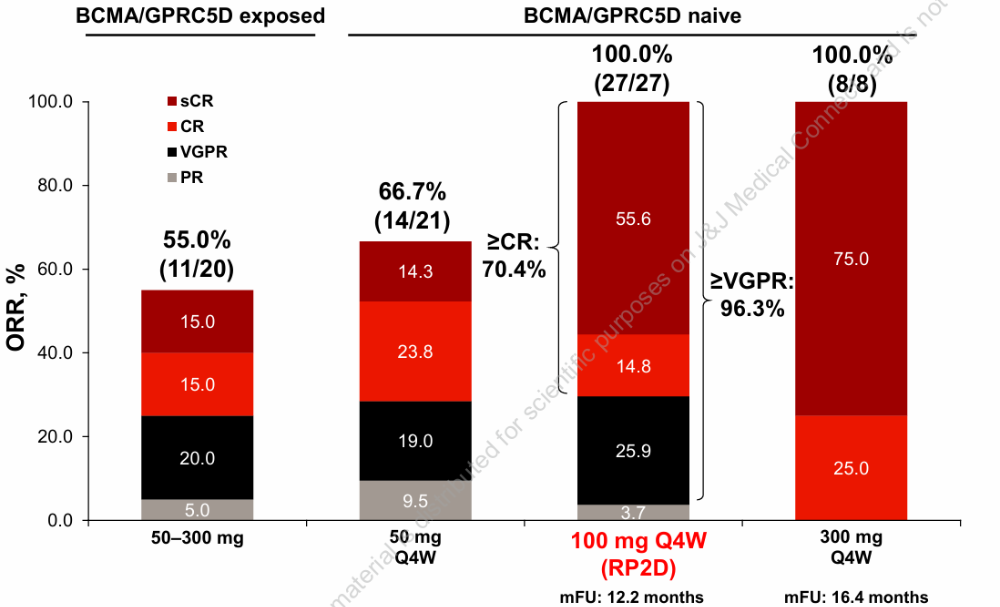
2025年ASCO大会上,强生的三抗JNJ-5322惊艳亮相,这款产品可同时靶向多发性骨髓瘤细胞上的BCMA和GPRC5D,以及T细胞上的CD3。
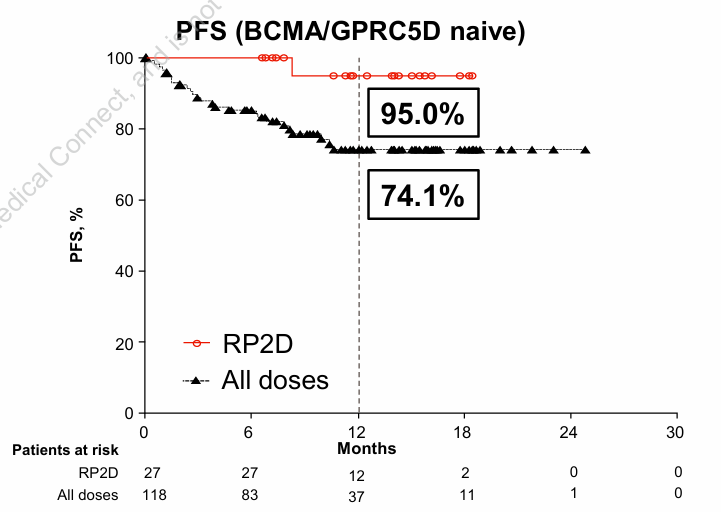
初步结果显示,接受II期推荐剂量 (RP2D) 的27例既往未接受过BCMA和GPRC5D靶向疗法的患者,实现了100%的ORR和70.4%的CR或以上的缓解率。12个月的 PFS率高达95.0%[2]。相比之下,强生的王牌CAR-T产品西达基奥仑赛在末线多发性骨髓瘤人群中的12个月PFS率大约为75%[3],这更加凸显了JNJ-5322疗效的优异。
从达雷妥尤单抗、西达基奥仑赛、特立妥单抗,再到未来的JNJ-5322,强生在多发性骨髓瘤各个先进分子领域的成功布局已愈发明朗。
除了逐渐趋近的疗效外,相比于CAR-T,抗体通常具有更温和的安全性特征和更低的3级或更高级细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)发生率。
这种“高缓解率+相对低毒性”的“CAR-T化”抗体,若未来获得更多数据支持,将会在临床上占据独特优势,抗体的下一个优化方向和治疗故事仍将是未完待续。
TONACEA
CAR-T“抗体化”
从“私人定制”到“即时供应”
从CAR-T市场化应用以来,“高价、难获取”的难题便挥之不去。
复杂的制造、漫长的耗时、高昂的成本,如同为每位患者量身定制一件“高级时装”。患者需要经历白细胞采集、体外基因修饰、细胞扩增等一系列步骤,整个过程可能长达数周,对于那些病情快速进展的患者而言,时间就是生命。高昂的治疗费用更是将许多患者拒之门外。
若CAR-T想如抗体药物般即取即用、门诊化,解决上述难题是必经之路。
异体CAR-T是CAR-T通用化方向的先行者,它利用健康供体的T细胞预先改造为CAR-T细胞,冷冻储存为“成品”,患者需要时即可快速复苏输注。省去了个体化采集和漫长体外培养,实现了“即取即用”(Off-the-shelf)的治疗模式。然而,异体CAR-T的治疗仍面临着一个巨大瓶颈:治疗去仍需清淋预处理。
近期热度飙升的体内CAR-T,则将多个体外步骤集中于体内完成,有望实现真正的“抗体化”:无需清淋,载体被直接注射入患者体内,利用患者自身T细胞作为“原材料”,在体内完成CAR-T细胞的制造。

截至2025年7月7日,公开披露体内CAR-T管线的公司有超30家,主要集中在中美两地,这其中已有临床产品报告了初步的临床数据,证实了体内CAR-T的可行性。
在《柳叶刀》最新发表的中国试验数据中,4例复发难治多发性骨髓瘤患者单次注射体内CAR-T后,2例达严格完全缓解(髓外病灶清除),2例部分缓解(微小残留病灶阴性),所有患者持续应答≥2个月。3例出现3级CRS,1例出现ICANS,均经糖皮质激素控制 [5]。
这款产品由EsoBiotec和普瑞金合作开发,EsoBiotec也借助体内CAR平台成功得到了制药巨头的青睐:阿斯利康将以高达10亿美元的价格收购EsoBiotec,这也是阿斯利康收购的第二家细胞疗法公司。EsoBiotec的慢病毒体内CAR-T和亘喜生物的Fast CAR-T平台将作为阿斯利康未来探索细胞疗法领域突破的重要方向[6][7]。
艾伯维也已斥巨资布局体内CAR-T。2024年1月,艾伯维和Umoja Biophama就慢病毒载体制造的体内CAR-T平台达成了两项战略合作[8],并在2025年6月宣布将以高达21亿美元的现金收购mRNA体内CAR-T开发企业Capstan[9]。作为全球免疫巨头,Capstan首发的自免适应症产品不仅有希望扩大艾伯维在免疫领域的领导地位,也将补齐艾伯维在细胞治疗上的短板。
诺华自Kymriah前线大B细胞淋巴瘤试验失败后,一直未曾有新适应症市场拓展,作为细胞疗法的先驱企业,除了充当西达基奥仑赛的代工厂,诺华也在积极寻觅着细胞疗法的其他可能。2024年11月诺华与Vyriad达成了体内CAR-T疗法的战略合作, Vyriad的体内CAR-T平台也是基于慢病毒载体。合作的金额暂未披露,未来Vyriad负责体内CAR-T候选药物的鉴定和开发,诺华将负责产品的临床推进[10]。
制药巨头对新兴技术平台的遴选下注背后不仅是资本的博弈,更是对一场即将到来的医疗技术革命的战略响应。
从短期来看,合作交易能实现双方开发方向的补齐或增强;中长期,则是掌握下一代CAR‑T的主导权和定义行业标准;更深远的则是通过体内CAR‑T,将昂贵、高门槛的细胞疗法,向普惠型、即时型的治疗体系推进。一旦成功,CAR-T疗法将不再是少数医疗中心的专属,而是能够像抗体药物一样,在更广泛的基层医疗机构中推广应用,惠及更多患者。
TONACEA
竞合共生
免疫治疗的黄金时代
CAR-T与抗体之间的这场“双向奔赴”,并非取代与被取代,而是一场深刻的竞合共生。它们在各自的进化过程中相互学习、相互融合,共同推动着免疫治疗的边界。
未来,市场可能不会简单地划分为“CAR-T市场”和“抗体市场”,而是会出现更多的交叉和融合。
例如,在疾病早期或对现有治疗不敏感的患者中,经过“CAR-T化”的抗体可能作为更便捷、更安全的初始选择;而对于复发/难治性患者,或者需要更深、更持久缓解的患者,则可能需要经过“抗体化”的体内CAR-T或更先进的CAR-T联合疗法。
药企的战略布局也应更加灵活,不仅要推动各自技术的突破,更要积极探索两者之间的协同和组合。从研发、试验到商业化,融合抗体与CAR-T的优势,满足患者多样化需求。
免疫治疗的未来充满无限可能。抗体的“CAR-T化”与CAR-T的“抗体化”,正是这场进化中最引人瞩目的趋势。它们各自在精准度、可及性、通用性和安全性上相互借鉴、相互促进,共同描绘出一幅超越想象的未来图景。
在这场充满活力的技术竞赛中,最终的受益者将是广大的患者,他们将拥有更多、更好、更可及的治疗选择,迎来战胜疾病的曙光。
上一页
相关新闻





