结合PD-L1 ADC数据,分析自免ADC的出路在哪里
更新时间:
2025-08-26 08:35:58.717

从Seagen披露的体外数据看,没有引起免疫系统毒性的原因(图1)是:1. T细胞对药物存在部分依赖于MDR1 (multi-drug resistance 1;多药转运体,帮助药物外排)的毒素抵抗作用。2.虽然巨噬细胞和DC会受毒素攻击,但比肿瘤细胞的杀伤浓度要低100倍。
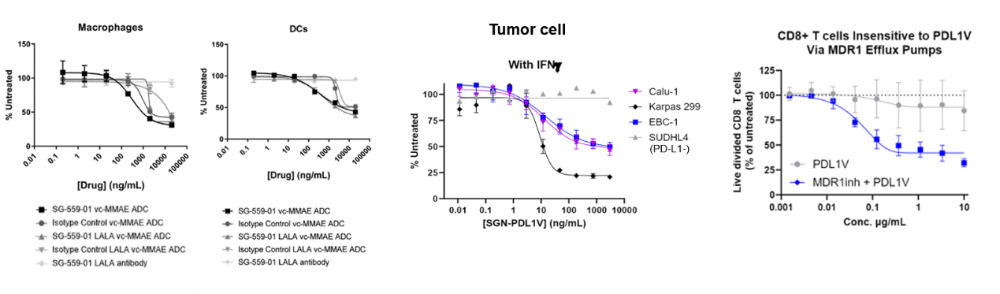
如果免疫细胞对ADC药物的反应是这样,那在自免中布局ADC有前途吗?国内多家药企在自免中布局ADC,包括映恩的anti-BDCA2 ADC,恒瑞和先声的anti-IL-4R ADC。不同于应用于肿瘤的ADC,上述提到的自免ADC偶联的都是糖皮质激素或糖皮质激素激活因子GRM(glucocorticoid receptor modulators)。目前披露临床药效的只有AbbVie的两款anti-TNFα GRM。我们来根据这些药物的临床前和临床数据,探讨未来自免ADC的方向。
TONACEA
Anti-BDCA2 ADC
作用于非常小的免疫细胞群体,anti-BDCA2会引起该靶点的持续降低。体外需要很高的浓度才能看到anti-BDCA2 ADC对比anti-BDCA2的优势。
1、靶点表达:BDCA2主要表达在DC的一个亚群pDC中,pDC占PBMC一般是0.2-0.8%。
2、作用机制:抗体与BDCA2结合后会诱导BDCA2内吞,降低I型IFN分泌。Biogen已开发anti-BDCA2抗体BIIB059,处于phase 3(2021年5月开始)。在anti-BDCA2抗体上偶联糖皮质激素,可加强对pDC的活性抑制。
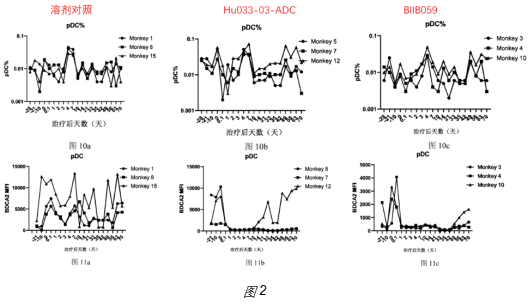
3、实际数据:在猴PD中未看到对pDC数目的影响,但anti-BDCA2抗体会引起持续的BDCA2表达的下降(图2);提示可能存在靶点介导的药物胞内递送不足。其文章未披露在pDC体系中所用的浓度;但在PBMC体系中,需要很高浓度(至少60nM以上)才能看到偶联糖皮质激素的优势(图3)。
TONACEA
Anti-IL-4R ADC
作用于广泛的免疫细胞和非免疫细胞。两款药物分别在哮喘和特异性皮炎中看到对比anti-IL-4R的优势。
1、靶点表达:IL-4R在多种免疫细胞和非免疫细胞上都有表达。免疫细胞包括,B细胞、肥大细胞、嗜酸性和嗜碱性粒细胞、巨噬细胞/DC/单核细胞和Th2细胞;非免疫细胞包括,纤维细胞、气道上皮细胞、气道平滑肌细胞和血管内皮细胞。
2、作用机制:IL-4R主要通过与配体IL-4和IL-13结合,调控B细胞中IgE抗体的产生、促进Th2细胞的分化等免疫功能。现在anti-IL-4R抗体已是治疗II型疾病,如哮喘、特异性皮炎和Th2型COPD的畅销药物。偶联激素会进一步促进anti-IL-4R的免疫抑制作用。
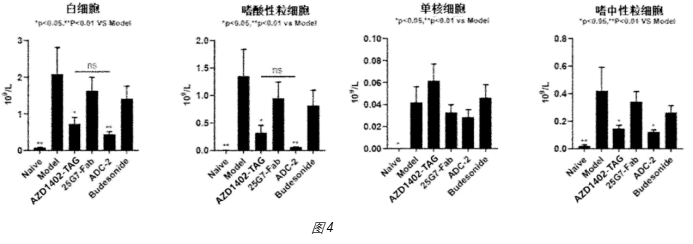
3、实际数据:恒瑞开发的anti-IL-4R ADC为可吸入形式,在小鼠哮喘模型中,可以看到ADC药物对比anti-IL-4R(25G7-Fab)以及等摩尔Budesonide的优势(图4)。先声开发的是半衰期延长的anti-IL-4R ADC,适应症选择的特异性皮炎;在小鼠特异性皮炎模型中,可以看到对比anti-IL-4R抗体的优势。
TONACEA
Anti-TNFα ADC
依赖膜型TNF(tmTNF)。TNFα本身在RA病人中表达并不高,提示作用靶点(tmTNF)表达水平较低。在免疫CII抗原+zymosan刺激诱导的RA小鼠模型中验证成功。但该模型会诱导较强TNFα,可能不同于仅用CII抗原免疫诱导的RA模型,跟临床RA症状也存在较大区别。在RA病人中,虽然安全性良好,但未见深度缓解。
1、靶点表达:TNFα为炎症因子,文献报导,在RA病人血液中上升提高约4倍,约为358±156pg/ml。一般非急性炎症疾病中,炎症因子的表达都不会太高。
2、作用机制:TNFα主要由巨噬/DC细胞、NK和T细胞产生。产生时先表达在膜上,为tmTNF;后被酶切割,形成soluble TNF。Anti-TNFα ADC与膜型tmTNF结合,内吞进入细胞后,介导更强免疫抑制功能。
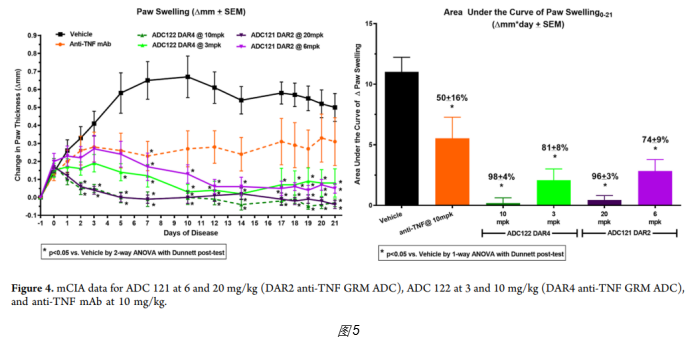
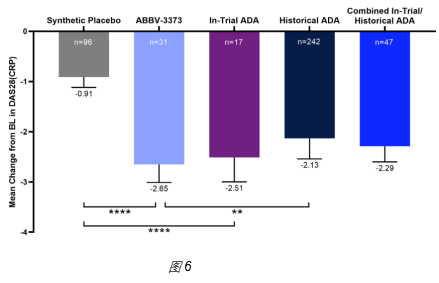
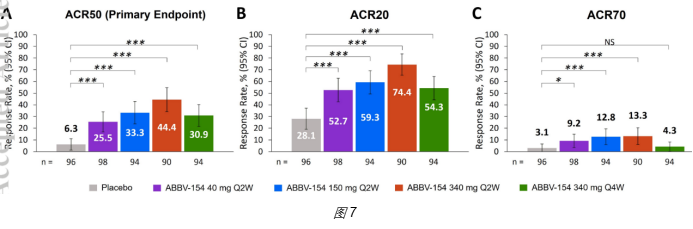
3、实际数据:AbbVie试图通过激活糖皮质激素受体,增强Adalimumab(anti-TNFα)的活性。开发的第一代ADC为ABBV-3373,在免疫CII抗原+zymosan刺激诱导的RA小鼠模型中,药效优于anti-TNF抗体(图5)。在临床RA病人测试时,对比了100mg ABBV-3373(IV给药)和80mgAdalimumab(ADA,SC给药)的疗效,发现ABBV-3373并未优于Adalimumab(图6)。由于Adalimumab已经广泛采用SC给药,ADC药物需能实现SC给药才更具有市场优势,所以AbbVie对连接方式、Linker及Payload进行了优化,开发了第二代ADC,即ABBV-154。在RA小鼠模型中,可看到药效优于anti-TNF抗体;在RA病人中,能看到疾病缓解作用,但未实现很高的深度缓解,ACR70最高只能达到13.3%(图7)。
综合以上数据看,偶联糖皮质激素或糖皮质激素激活因子的安全性问题不大,但要保证药效,需要关注靶点在免疫细胞中表达范围以及表达水平。LifordiImmunotherapeutics是一家专注于自免药物递送的公司,在去年9月获得7000万美元A轮融资。这家公司在自免的研发策略可以给我们提供一些方向:
1、靶向单核细胞类靶点。这家公司开发的自免ADC药物LFD-200,选择的靶点是VISTA,偶联的是budesonide。VISTA广泛作用于单核/DC细胞、中性粒细胞和部分T细胞。据披露,LFD-200可以实现在淋巴结和骨髓中payload的聚集,在该部位的PK远长与血液系统中游离payload的PK。可能由于在整个炎症过程中,单核/DC细胞不断向脾、淋巴结等免疫组织聚集,起始免疫反应;中性粒细胞不断进入骨髓进行recycle导致。这样可以有利于延长给药时间和提高安全性。
2、Payload选择其它类型,包括RNAi、肽或者蛋白等。Lifordi披露了anti-VISTA中偶联PI3K RNAi的体外和体内数据,可以看到较好且广泛的免疫抑制。有文献报导,可以通过DC marker DEC205偶联促进DC抗原提呈的蛋白,靶向DC进而增强肿瘤的免疫反应。目前自免ADC中payload的探索,没有肿瘤中的多;但偶联RNAi、肽或者蛋白已是一个新的方向。
很多自免疾病,如特异性皮炎、哮喘、RA和IBD领域还没有发现能够实现深度缓解的药物。通过靶点和payload的选择,从机制分析,自免ADC还是有望实现自免疾病的深度缓解的。
相关新闻





