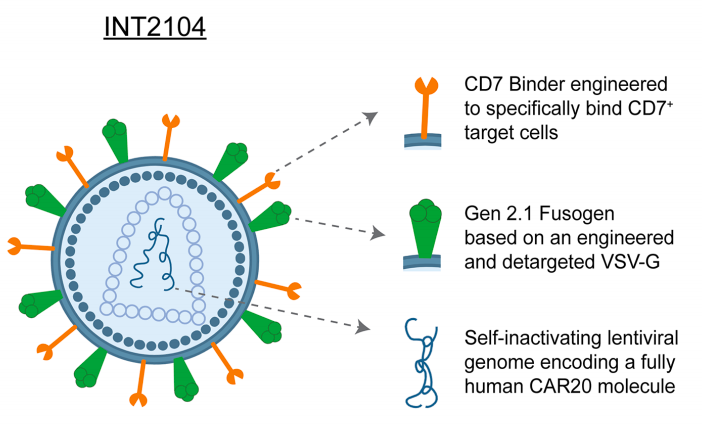
从Interius看IN VIVO CAR-T慢病毒平台设计思路
更新时间:
2025-08-27 08:15:32.031

Interius BioTherapeutics 是一家领先的生物技术公司,正在开发新型现成的基因疗法,利用靶向慢病毒载体技术在体内生成自体嵌合抗原受体 (CAR) 细胞。2021年5月,该公司完成7600万美元A轮融资,本轮融资由CormorantAsset ManagementFairmountFund共同领投。
2024年7月10日,Interius BioTherapeutics宣布,已获得澳大利亚治疗用品管理局(TGA)的人类研究伦理委员会(HREC)批准和临床试验通知(CTN)许可,以进行其在研体内CAR-T疗法INT2104的临床1期试验,用以治疗B细胞恶性肿瘤。Interius计划在2024年第四季度开始试验,并有望在2025年第一季度实现关键里程碑。Interius即将进行的1期试验INVISE将评估单次INT2104输注在难治性/复发性B细胞恶性肿瘤成人患者中的安全性。这项全球性的试验采用两部分、多中心、开放标签、单剂量设计,剂量递增部分旨在确定试验和未来研究中使用的INT2104剂量。
2025年1月7日,德国监管机构Paul Ehrlich批准INVISE拓展到欧洲进行1期临床试验。
TONACEA
Interius的慢病毒平台的设计思路
vsv-g因其嗜性广泛,转导效率高等优势成为ex vivo CAR-T中最成熟的包膜蛋白假性,并因此积累了较多CMC以及安全性经验,也成为当前IN VIVO CAR-T开发的热门选择,但从体外转到体内,vsv-g假性慢病毒开始面临新的问题:
vsv-g易被人类血清灭活,直接输注入体稳定性差。
vsv-g通过结合LDL-R实现与靶细胞的膜融合,但LDL-R在人体内广泛分布,这种广泛嗜性会带来较高的脱靶风险;
为了解决上述问题,Interius进行了如下探索:
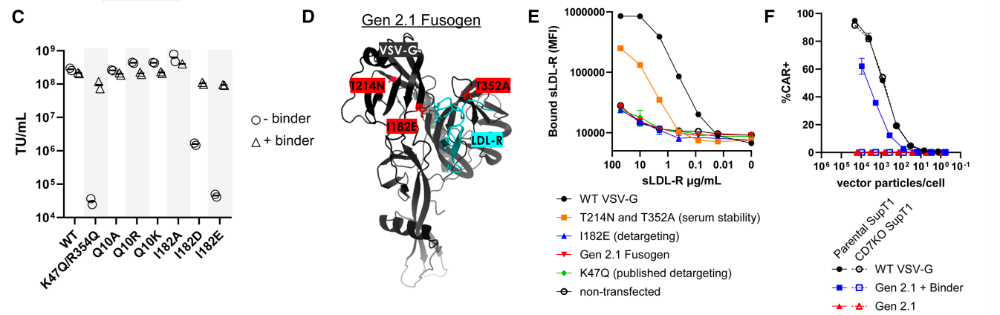
• 引入已有报道的氨基酸替换(T214N和T352A),增强vsv-g血清和热稳定性。
• 对vsv-g进行特定位点突变,只保留融合特性而去掉与LDL-R的结合特性。
既往研究发现,特定氨基酸突变(如K47Q)能阻断VSV-G与其天然受体低密度脂蛋白受体(LDL-R)的结合,同时保持其膜融合活性。为筛选更多可能使VSV-G对LDL-R"失明"的突变位点,通过计算机模拟分析了野生型VSV-G与LDL-R复合物的晶体结构,重点探查靠近LDL-R带电残基的VSV-G氨基酸位点。
除已报道的致盲突变外,该方法还鉴定出Q10与I182两个候选位点:Q10正对LDL-R富含半胱氨酸结构域(CR3)中的R103,而I182则朝向驱动大部分结合作用的带负电残基D110与D112。研究者推测在这些位点引入相反电荷(如Q10K或I182E)将破坏VSV-G与LDL-R的结合稳定性。
突变载体转导CD7+ SupT1细胞的试验显示,Q10位点替换未能有效阻断VSV-G功能,载I182位点带电替换(I182D和I182E)均能有效解除VSV-G靶向性。最终选择单氨基酸替换I182E用于解除靶向,因其在高载体颗粒投入量时比I182D产生更少的非依赖结合分子转导现象。
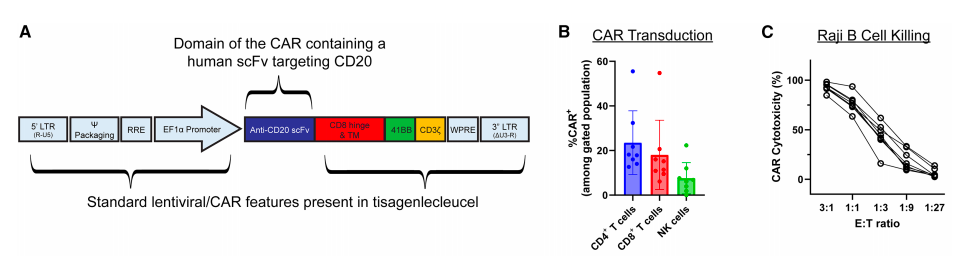
这种结合了I182E、T214N和T352A替换的优化融合蛋白,被命名为第二代改进型(Gen 2.1)融合蛋白
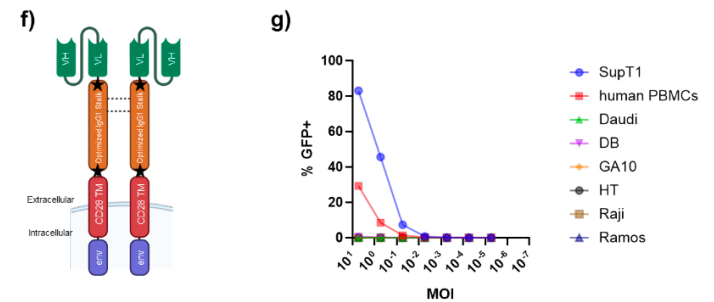
该结合分子的初代设计为抗CD7单链可变区片段(scFv),通过人源CD28跨膜区锚定于载体囊膜表面,并经由人类免疫缺陷病毒1型(HIV-1)gp41蛋白的囊膜掺入基序连接免疫球蛋白G亚类1(IgG1)Fc"茎秆"结构。但后续发现其既能转导CD7阳性细胞,也能转导部分CD7阴性B细胞系,这表明结合分子组分与靶区细胞之间存在scFv元件之外的相互作用。
为降低fc受体介导的转导风险,interius在优化版结合分子茎秆结构中引入了多重突变,以消除Fc介导的效应功能,并证实该设计可将GFP载体转导限制于CD7阳性细胞(SupT1细胞及人外周血单个核细胞[PBMCs]),而对所评估的B细胞系未检测到转导活性。
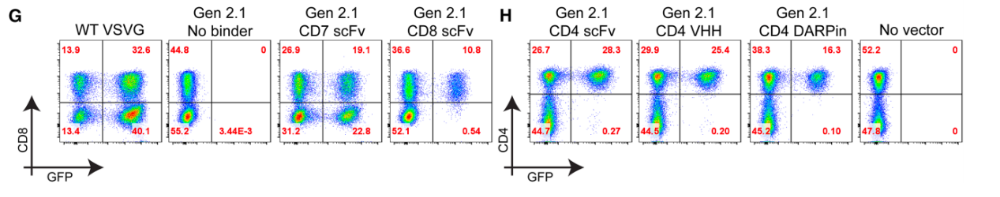
通过多种不同靶向分子靶向多种表面抗原的binder,以实现对特定细胞的定向结合。为展示这种灵活性,研究团队采用靶向CD7、CD4或CD8的单链抗体(scFv)binder对载体进行假型化处理。使用CD4和CD8结合剂制备的载体分别选择性转导了CD4+和CD8+细胞,而基于CD7 scFv的结合剂则转导了CD7+细胞(该群体同时包含CD4+和CD8+T细胞)。
为验证引导载体转导的结合剂类型的灵活性,研究团队将CD4 binder分别构建为单链抗体(scFv)、重链可变区(VHH)和设计的锚蛋白重复蛋白(DARpin)形式用于PBMCs转导,这些不同构型均能实现类似的抗原特异性转导功能。这种特异性在三位受试供体中均保持稳定。
TONACEA
INT2104的临床前评价
用INT2104处理活化的人外周血单个核细胞(PBMCs)后,成功转导了CD4+、CD8+T细胞及NK细胞。转导效率与体外CAR-T细胞制品生产过程中的水平相当。经INT2104转导的人PBMCs对B细胞系显示出剂量依赖性高效杀伤作用。
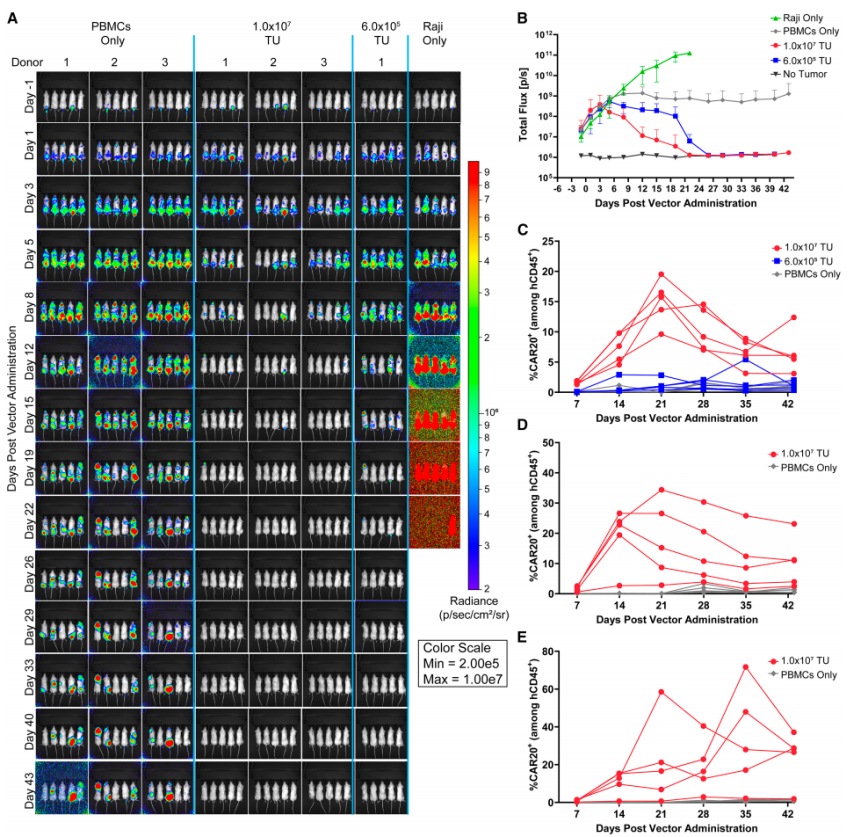
建立Raji B细胞肿瘤负荷鼠模型,然后通过尾静脉注射静脉给药。
采用高剂量INT2104(1×10⁷ TU/只)治疗的15只小鼠中,来自三位供体的所有动物均在治疗后第22天完全清除肿瘤,而移植活化PBMC的对照组小鼠则未出现肿瘤消退。
低剂量组(6×10⁵ TU/只)的五只小鼠也最终清除了肿瘤,但清除速度慢于高剂量组,所有肿瘤在第26天被完全消除。
通过流式细胞术对每周采集的血液样本进行CAR+细胞检测,高剂量组小鼠外周血中自第14天起可检测到CAR+细胞,该时间点与B细胞耗竭现象同步出现。低剂量组五只小鼠中仅有两只能检测到可定量的循环CAR+细胞。
INT2104治疗耐受性良好,所有接受治疗的小鼠均存活至研究预设时限,且未出现与载体输注相关的体重减轻事件。
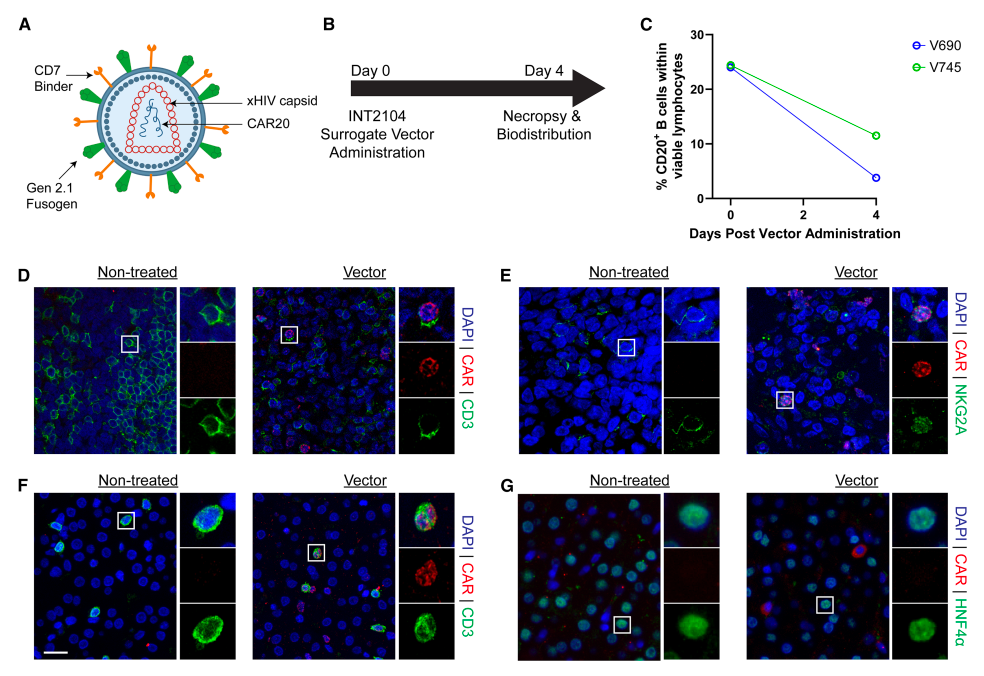
在证实人源化小鼠静脉注射INT2104能产生功能性CAR+细胞后,研究团队采用食蟹猴模型进一步评估大动物模型中的靶向特异性。
作为临床候选药物的INT2104采用野生型人类免疫缺陷病毒1型(HIV-1)gag-pol质粒生产,而食蟹猴存在针对HIV的宿主细胞限制因子(如TRIM5α32,33),因次研究使用嵌合HIV/SIV gag-pol(xHIV)制备了替代载体用于NHP实验。该INT2104替代载体仅在编码衣壳的gag区域与INT2104存在差异,但保留了相同的第二代Fusogen、CD7结合域及CAR20转基因。
为评估大动物模型中T细胞与NK细胞的靶向转导潜力,研究人员在第0天给两只成年食蟹猴静脉输注了2×10⁹TU的INT2104替代载体(约3.5×10⁸ TU/kg)。在预定解剖日(给药后第4天)前对受试动物进行为期4天的监测,并与未经处理的雄性对照动物进行比较。在计划解剖时(给药后第4天)观察到B细胞耗竭现象,两只接受治疗的NHP外周血CD20+B细胞均减少50%以上(V690号动物减少84%,V745号动物减少53%)。
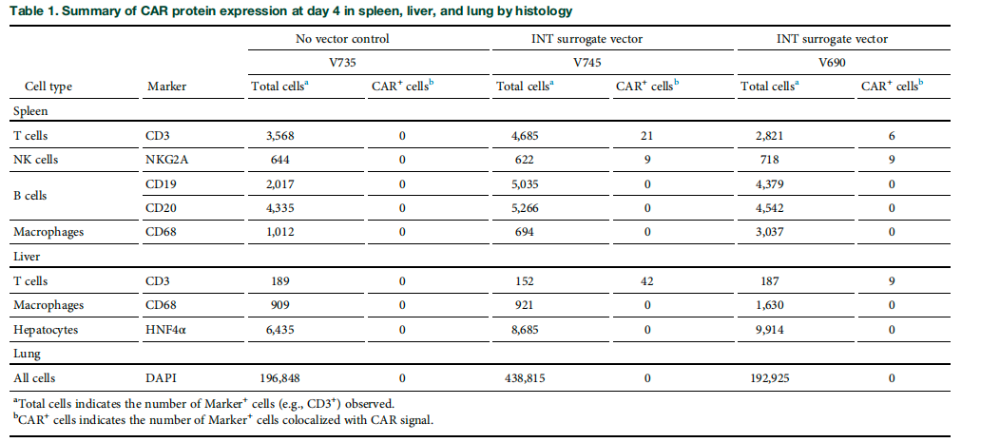
通过ddPCR技术,在第4天检测外周血单个核细胞(PBMCs)、骨髓单个核细胞(BMMCs)及脾脏、肝脏、肺脏等组织中前病毒DNA基因组,完成生物分布评估。生物分布分析显示,在计划性尸检第4天,已知含有CD7+细胞的脾脏、肝脏、外周血单个核细胞、骨髓和肺脏组织中前病毒DNA水平最高。
基于该生物分布分析结果,研究人员采用免疫荧光组织学方法探究肝脏、脾脏和肺脏中哪些细胞表达CAR蛋白,研究发现与载体靶向CD7+细胞的特性一致,CAR20蛋白仅见于T细胞和NK细胞。在两只经载体处理的非人灵长类动物脾脏和肝脏中,均检测到表达CAR的T细胞(定义为CD3+)。两只受试动物的脾脏中也检测到表达CAR蛋白的NK细胞(定义为NKG2A+),但在肝脏切片中未发现NK细胞。值得注意的是,肝脏中未检测到表达CAR蛋白的肝细胞(定义为HNF4α+)。脾脏中评估的B细胞(CD19+或CD20+)也未检出CAR+细胞。
巨噬细胞作为已知能吞噬颗粒物质的清道夫细胞,既往研究报道其可摄取慢病毒。本研究中,无论经处理的动物脾脏或肝脏中。与先前报告一致,通过RNAscope检测在治疗动物肝脏巨噬细胞中观察到慢病毒颗粒摄取迹象。两只载体处理的非人灵长类动物肺部切片中均未检测到表达CAR蛋白的细胞。在载体给药后第4天进行尸检前,两只载体处理动物均未出现载体相关毒性或安全性信号。
这些生物分布数据表明:采用CD7 Binder与Gen 2.1 Fusogen组合对INT2104进行假型化后,能实现静脉给药后对T细胞和NK细胞的特异性靶向。
相关新闻





