百亿市场,“地狱”攻关
更新时间:
2025-08-28 08:06:40.814
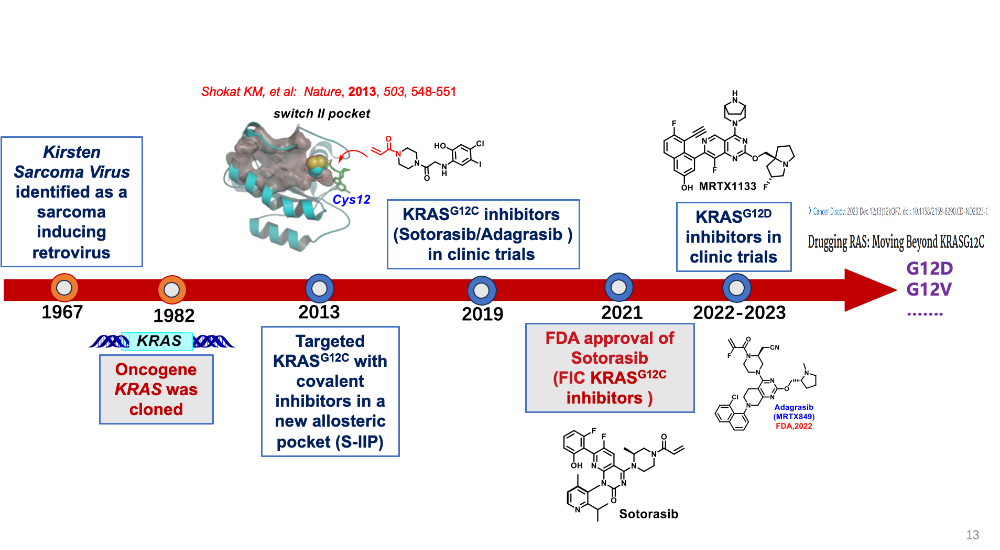
自1984年被发现是肿瘤驱动基因以来,KRAS靶向药的探索道路艰难曲折。直至2013年,加州大学教授Kevan Shokat的研究带来重大转机,才使KRAS抑制剂的开发迎来曙光,并迅速成为肿瘤领域最热门的赛道之一。
在KRAS突变类型中,不同类型突变占比各异,不同癌症突变发生率也有别。
G12是KRAS最常见的突变位点,占到所有突变位点的83%。其中,G12D突变发生率最高,占33%,远超G12V(23%)、G12C(11%)和G13D(12%)。
另外,从格局上观察,KRAS G12D抑制剂的竞争不同于KRAS G12C的竞争白热化,目前全球尚未有KRAS G12D抑制剂上市,仍有很大突围空间——由此,KRAS G12D的开发热度持续攀升。
Insight数据库显示,全球目前共有26款 KRAS G12D抑制剂进入临床阶段,部分已进入临床II期,还有不少正在开发的临床前分子。此外,抑制多种KRAS突变类型的泛KRAS(Pan-KRAS)产品也在加速布局中。
8月,拜耳一笔交易,再度把目光引向KRAS G12D,这是一款由Kumquat Biosciences开发的分子,7月刚拿到FDA的IND批准。该合作对价总额高达13亿美元,再度验证了KRAS G12D的潜力。
EvaluatePharma曾预测,全球KRAS G12D靶向药物市场规模将在2035年达到120亿美元。眼下,我们可以期待:KRAS G12D,会催生下一个爆点吗?
TONACEA
“地狱级”的突围难度
直至2013年,Kevan Shokat团队突破性地发现:KRAS-G12C突变体蛋白上面存在着一个可以与小分子药物结合的“口袋”,小分子化合物与这个“口袋”结合后能够将KRAS-G12C突变体“锁死”在失活的构象,从而抑制其持续激活下游通路,达到抑癌作用。
这一机制催生了全球首个KRAS抑制剂,一举打破KRAS基因“不可成药”的魔咒,受此鼓舞,更多药企也开始将目光投向KRAS的各个突变位点,甚至是泛KRAS抑制剂的研发。
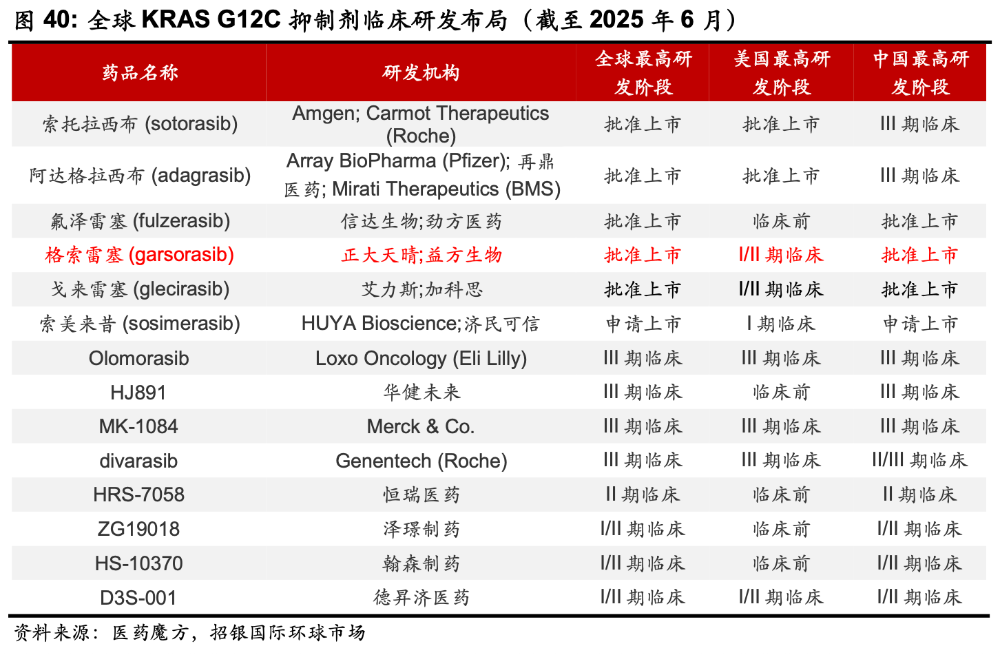
截至目前,全球共有5款KRAS G12C抑制剂获批上市,分别为安进的Lumakras、BMS/Mirati的Adagrasib、信达生物/劲方生物的氟泽雷塞、正大天晴/益方生物的格索雷塞、艾力斯/加科思的戈来雷塞,首批适应症均为KRAS-G12C突变型的晚期非小细胞肺癌(NSCLC)。
相比之下,突变比例占比更高的G12D位点,应用场景更为吸引人,KRAS G12D突变占胰腺导管腺癌全部患者的36%-40%、结直肠癌的12%-13%和非小细胞肺癌的4%,还有胆管癌、卵巢癌等。
以胰腺导管腺癌为例,它是最常见的胰腺癌类型,约占病例的85%,当前除化疗外几乎没有治疗选择,五年生存率不到10%。而作为全球癌症相关死亡的第六大原因,胰腺癌发病率每年持续上升,预计到2050年新病例将增加95.4%,全球新病例总数可能达到998663例。
庞大的临床需求对应着空缺的市场,全球尚未有获批上市的KRAS G12D抑制剂。原因就在于,KRAS G12D抑制剂的研发难度和挑战进一步升级。
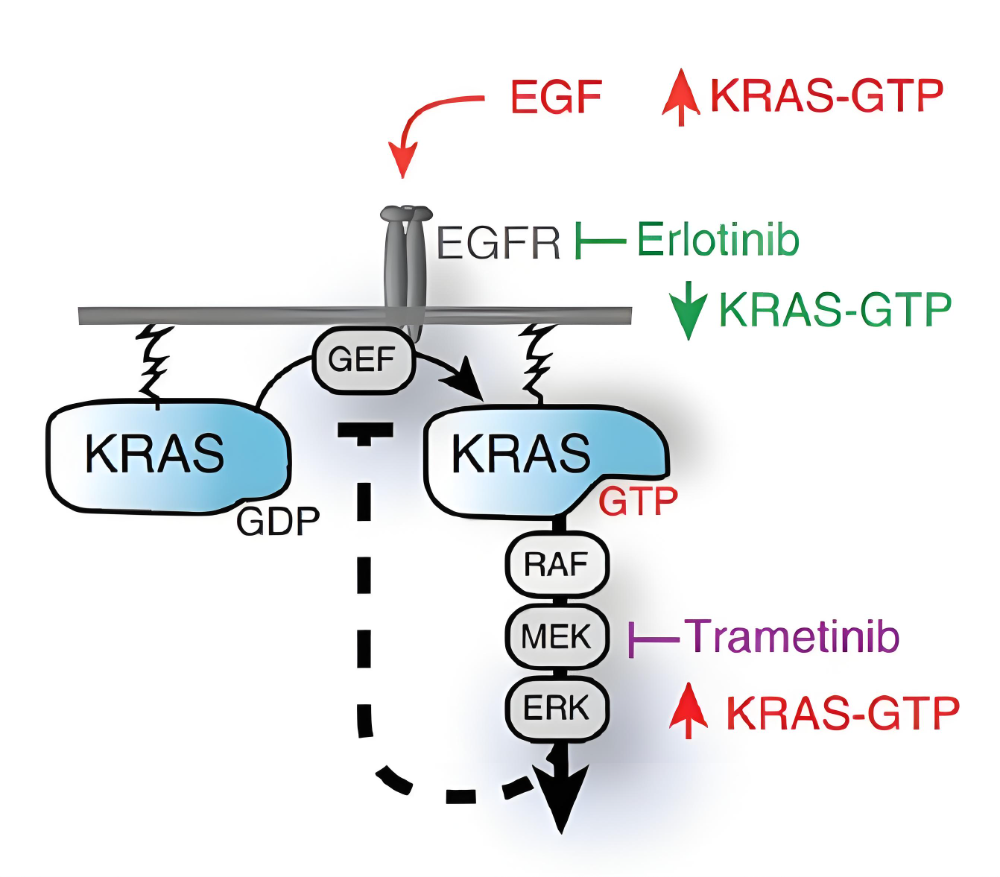
KRAS G12D是KRAS第12号密码子突变为天冬氨酸,而不是半胱氨酸,相当于没有像G12C那样的“抓手”,因此KRAS G12D无法与Switch II口袋附近的氨基酸残基进行共价结合。
另外,相对于KRAS G12C,G12D突变体的内源性GTP水解酶(GTPase)活性低,导致在体内G12D更多以GDP活动状态存在,因而像KRAS G12C抑制剂一样通过共价修饰把分子锁死在GTP状态的开发形式,对G12D抑制剂开发非常具有挑战性。
TONACEA
“冰与火之歌”
尽管挑战重重,但针对KRAS G12D的研发仍然热度很高。
包括安斯泰来、阿斯利康、礼来和罗氏等公司都拥有处于临床阶段的KRAS G12D抑制剂、降解剂以及TCR工程化T细胞等相关研发项目。随着与Kumquat授权交易的达成,拜耳也加入到这场战局中。
国内企业在KRAS G12D研发上也是奋起直准,恒瑞医药、艾力斯、泰励生物、海博为药业、劲方医药、和誉医药等十余家药企布局。
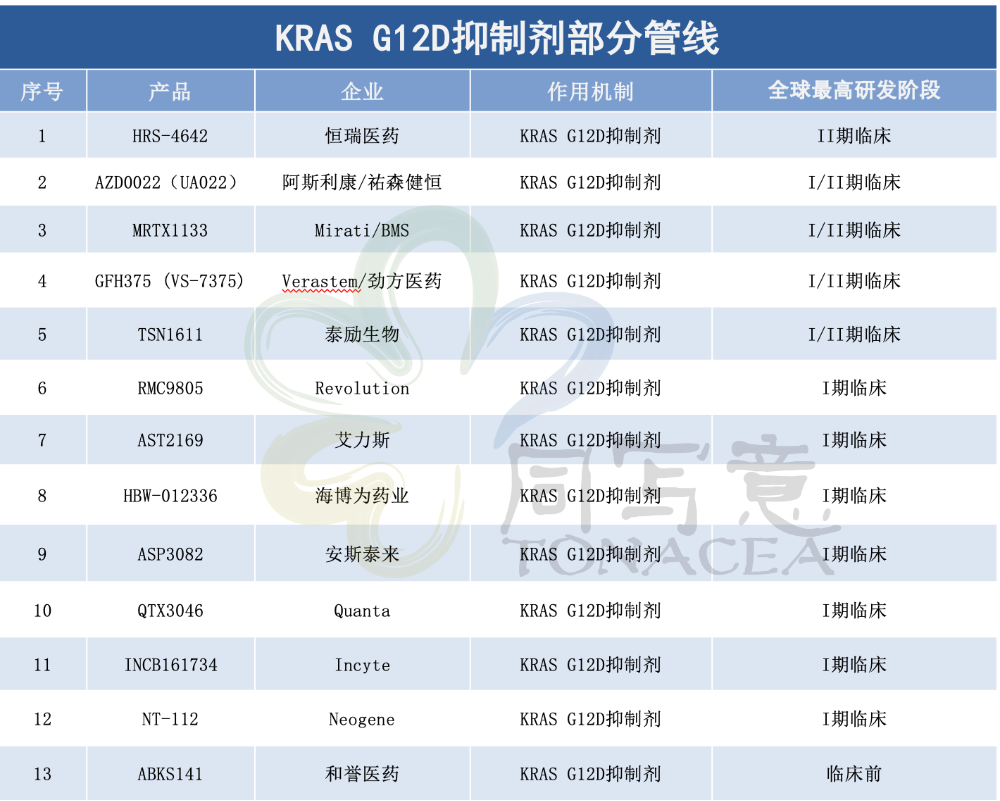
2023年,国产KRAS G12D还曾诞生过两笔重要交易:祐森健恒的临床前项目UA022,以2400万美元首付款、加上最高3.95亿美元里程碑付款和销售分成授权给阿斯利康;劲方医药以6.25亿美元的总包,将GFH375在内的三款自主研发的RAS通路靶向药创新疗法,授权给Verastem Oncology。
尽管业界对KRAS G12D抑制剂的兴趣日益高涨,但有巨头却已悄然退出这一赛道。
2025年3月,BMS宣布终止KRAS G12D抑制剂MRTX1133的研发项目,导致项目终止的关键原因是药代动力学数据“高度可变且不理想”。
MRTX1133由BMS收购Mirati获得,Mirati可以说是对KRAS靶点最熟悉的生物技术公司之一,它是全球第二款KRAS G12C抑制剂Adagrasib的开发者,MRTX1133正是Mirati主攻的第二个分子。
MRTX1133是在KRAS G12C药物的基础上,通过采用吡啶并[4,3-d]嘧啶骨架进行筛选和优化得到的分子。
理论上,MRTX1133可以通过非经典氢键和离子对相互作用占据Switch II口袋,与KRAS G12D的失活和激活状态结合,从而抑制KRAS G12D的活性。
此前,体外研究验证了MRTX1133的特异性和效力。在体内试验中,MRTX1133促使所有模型的深度肿瘤消退,包括14天后的完全或接近完全缓解。
MRTX1133于2023年以口服给药形式进入I期临床(NCT05737706),最终于两年后终止试验。BMS发言人指出,药物在体内的吸收、分布、代谢和排泄过程受到严重影响,极大地削弱了药效。
“先驱”的翻车固然令人意外,但也再度凸显了,KRAS靶点的突围绝非易事。
TONACEA
下一步的想象空间
MRTX1133临床试验的终止,不是KRAS G12D靶向治疗的终结,反而这款“先驱”产品的探索,为后续前行者标示出了一条路线图,为后续分子优化、机制创新和制剂突破提供参考性。
在2025年AACR年会上,阿斯利康公布了其口服KRAS G12D抑制剂AZD0022,该分子即为此前祐森健恒授权的UA022,结构上与MRTX1133有显著相似性,但在多个临床前动物模型中表现出口服生物利用度超过10%,显示出更佳的体内药代动力学特性。
目前,该药物正在I/IIa期ALAFOSS-01临床试验,作为单药疗法以及与EGFR抑制剂联合用于治疗胰腺癌、 结直肠癌和非小细胞肺癌患者。
另一款具有MRTX1133类似特征的临床候选药物是恒瑞医药的HRS-4642,已进入II期临床阶段,并在每周一次(QW)静脉注射给药方案下观察到临床疗效。
整体来看,目前全球大多数单靶向KRAS G12D的抑制剂处于临床早期,相较之下,Revolution Medicines的Pan-KRAS抑制剂Daraxonrasib(RMC-6236)跑得最快,处在临床III期。
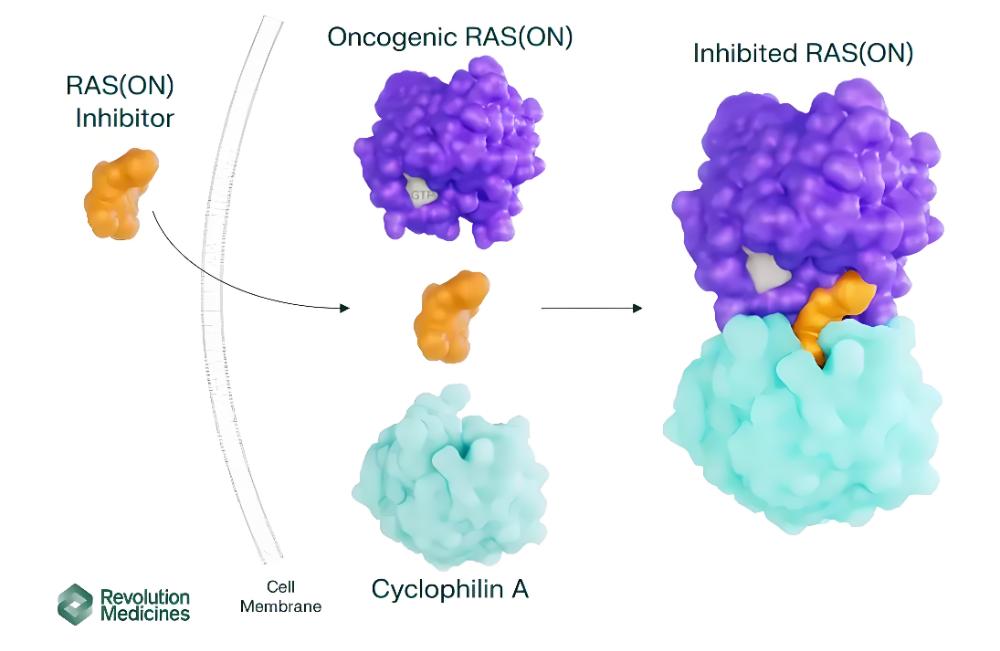
Daraxonrasib提供了一种作用机制完全不同的治疗思路,作为全球首个靶向RAS活性态的三元复合体抑制剂,其通过创新性地与亲环蛋白A结合形成稳定复合物,成功阻断了多种RAS突变体(包括G12C、G12D、G12V等)的信号传导。
这种突破性机制使得该药物在治疗RAS突变胰腺癌患者中展现出显著疗效,临床数据显示其中位无进展生存期达7.6个月,总生存期延长至14.5个月,为这类难治性肿瘤患者带来了新的希望。
随着肿瘤治疗已进入联合治疗时代,Daraxonrasib也在这一领域展现出巨大潜力。
例如,Daraxonrasib联合帕博利珠单抗(K药)一线治疗KRAS突变NSCLC的初步临床数据显示,在PD-L1高表达(TPS≥50%)患者中,ORR达86%,DCR达100%;在PD-L1低表达(TPS<50%)患者中,采用三联方案(Daraxonrasib+K药+化疗),ORR达60%,DCR达90%。
Pan-KRAS抑制剂的开发同样赛道拥挤,目前全球范围内在研的Pan-KRAS抑制剂近35 款。除了以Daraxonrasib为代表的分子胶路线,另外还有以辉瑞、礼来、加科思等同类的小分子抑制剂路线。

在国内,加科思JAB-23E73和璎黎药业YL-17231已推进至临床阶段,百济神州BGB-53038也于去年12月在国内首次获得临床批件。
展望未来,KRAS靶向治疗领域的发展方向已清晰可见:开发下一代KRAS抑制剂,覆盖更多突变类型,从G12C、G12D、G12V到pan KRAS;不断拓展适应症范围,从肺癌到胰腺癌、其他RAS突变肿瘤扩展;并通过优化联合策略,探索与免疫治疗、化疗及其他靶向药物的最佳组合方案等。
相关新闻





