数据向好,康方跌倒?
更新时间:
2025-09-10 08:02:23.679

9月7日,康方生物海外合作方Summit Therapeutics,在2025年世界肺癌大会上披露HARMONi研究最新成果,中位随访时间延长至13.7个月后,西方患者数据成熟度提升,OS的HR缩小至0.78(p=0.0332)。
与5月公布的数据相比,此次更新显示OS获益有所改善,但仍未达到研究预设的统计学显著性阈值(p≤0.0448)。在PFS方面,依沃西组显著降低疾病进展或死亡风险达48%(HR=0.52,p<0.00001),已达到研究的主要终点。
康方生物表示,HARMONi研究根据FDA的要求,随机纳入了约38%的北美和欧洲的患者。最新分析表明,西方和亚洲患者包括OS和PFS在内的临床研究终点获益“高度一致”。
然而,一场本应属于胜利者的庆典,骤然变成质疑与交锋的战场。
一边,资本市场上演了截然不同的剧情。9月8日港股开盘,康方生物股价不涨反跌,跌幅一度接近10%。次日,股价继续下探0.84%——这多少折射出投资者的态度分化。
另一边,华尔街的分析师们提出了尖锐质疑:为什么在长期随访中,西方患者的PFS改善率(33%)明显低于中国患者(45%)?如果东西方患者数据真的“高度一致”,为何试验会如此迅速地触达OS最终分析点,以至于西方人群的随访时间仅有9.2个月,远短于中国患者的32.7个月?
更核心的问题是:在一个强调“OS为王”的监管时代,仅凭强大的PFS数据和OS趋势,能否真正说服FDA?
基于前述种种质疑,同写意采访了Biotech创始人、药企数据统计部门高管、FDA前审评官员等业内人士,尝试从不同的观测维度,梳理出一些理解这款潜在“药王”的脉络。
事实上,围绕依沃西这款药物数据的争论,也远超出一个药物、一家公司的命运本身。
它触及了中国创新药出海的核心痛点:国际多中心临床试验的设计如何经得起推敲?当遇到东西方人群差异时,该如何证明数据的一致性?与Summit这样的美国Biotech合作,是否不如跟MNC的联姻来得稳妥?
站在数据与监管的十字路口,依沃西的遭遇正在成为整个行业的试金石——中国创新药的出海之路,究竟需要怎样的科学严谨性、国际临床能力和战略耐心?
所有人都在等待FDA的最终判决,而这场判决的意义,早已超出了一款药物的范畴。
TONACEA
对OS的困惑
“强烈谴责公司在明明Hamoni试验已经进行最终的OS分析且没有达到统计学显著性的情况下,不明确披露海外OS已经进行OS最终分析且没达到统计学显著性。”雪球上,一位用户言辞激烈地指责。
在HARMONi试验中,尽管PFS达到了预定目标,但依沃西在另一个主要终点OS方面的表现,未能满足市场的高期待。
礼邦制药首席科学官肖申解释说,早在5月进行初步分析时,依沃西的mOS是16.8个月,对照组为14个月,HR为0.79。“这个结果应该算有临床意义的差异,但P=0.057,高于预设阈值(0.0448),所以没有达到统计学上的显著性。”
作为合作方的Summit,当时也提及相关数据。不过,最初的对外沟通措辞,给许多投资者和分析师留下了这样的初步印象:HARMONi未来仍有机会在OS方面达到统计学显著水平。
8月,康方生物在发布的半年业绩报告中表示,“依沃西展现出良好的OS获益趋势”。
此次世界肺癌大会的报告证实,HARMONi在最终分析中,OS获益进一步提升。但是,有两个问题需要回应。
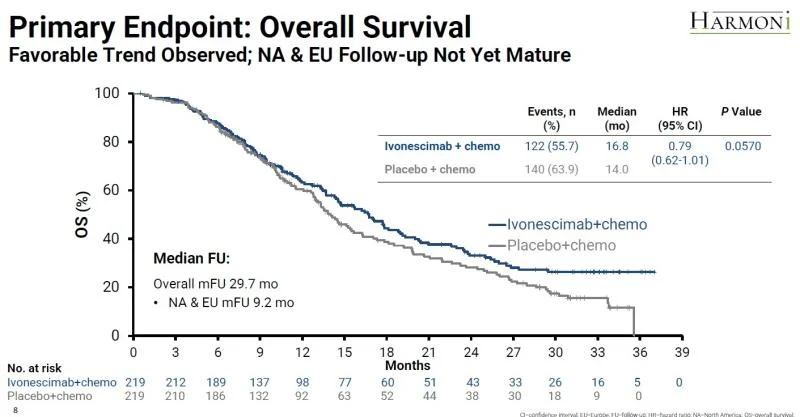
首先,HARMONi研究“4月DCO锁库了,9月数据还能用吗”?一篇文章解释说,DCO并非“终点线”,它更像是“快照”,只要统计分析计划里写清事件驱动规则,就能按预设事件继续随访下去。
简而言之,对于HARMONi研究,261例是方案写定的“终点线”,以事件为终点。由于4月尚未到事件终点,所以9月更新的数据是可被考虑的。
其次,虽然随着随访时间延长,患者OS获益持续改善,却也改变不了“未能达到OS临床终点”的事实。这与Summit此前披露的结果一致:依沃西联合化疗组的死亡风险为21%,p值为0.057,而统计学显著性标准设定是0.0448。
来自Leerink Partners的分析师说,这意味着,Summit哪怕重新审视OS,也无法就探索性分析宣称具有统计学意义,因为该分析并未被前瞻性地纳入正式的统计计划中。
最终的OS分析是由于438人试验中261例死亡而触发的。当时,依沃西联合化疗组有122例患者(56%)死亡,化疗组有140例患者(64%)死亡;mOS分别为16.8个月和14个月。
缺少足够坚实的OS数据,对依沃西来说尤其糟糕,因为FDA已告知Summit,需要有统计学上显著的OS获益,才能支持其在二线EGFR突变NSCLC治疗中的批准——至少这项适应症如此。
不过,一位临床专家向同写意表示,“OS statistically significant不如clinicall meaningful重要”,OS HR落在0.75-0.80之间,就已经是有临床获益的好药。
石药集团CMO黑永疆也觉得,从综合数据考虑,依沃西呈现的价值定位是应该整体导向的,不能因为OS没有达到统计学上的显著差异就一棒子打死。在这种语境下,PFS达到临床终点、OS持续改善,仍有较大机会进入美国市场。
TONACEA
“一致性”问题
Summit对新的数据感到鼓舞,康方生物也声称西方和亚洲患者包括OS和PFS在内的临床研究终点获益高度一致,尽管如此,数据结果却仍然引发困惑。
如果Summit使用HARMONi-A作为基准来设计HARMONi,同时假设依沃西在中国和西方患者中的表现相似,那么,HARMONi是怎样如此迅速地达到最终OS分析的触发点,以至于对于FDA最重要的西方人群的9个月随访显然太短了?
一种可能的解释是,在依沃西能够证明其治疗效果的最初几个月里,西方人群的死亡速度比预期要快。
Summit首席商业和战略官Dave Gancarz否认了这种猜测。他透露,当试验达到预设的死亡事件数量时,在西方人群的死亡事件比预期要少。
对OS曲线的Fierce分析显示,两项试验之间存在一些早期差异。
HARMONi研究中,依沃西获益在9个月后开始显现。而根据2024年公布的中位随访期17.6个月的数据,HARMONi-A研究的试验组和对照组的生存曲线分离耗时约一半,即在第5个月之前。到第9个月,依沃西联合化疗组在患者生存概率方面已较单纯化疗组高出4.4个百分点的绝对优势。
HARMONi-A进行首次中期OS分析时,数据截止时间为2023年6月,中位随访期为10.2个月,结果与此类似。2023年5月,Summit正式启动HARMONi试验。
国内一位统计学背景的审评专家向同写意表示,西方人群的入组时间短,导致随访时间偏少,有可能在事件数达标时依沃西的疗效还未得到展现,从而稀释了最终的获益,造成阴性结果结果。
对于数据的“一致性”,Summit临床开发负责人Jack West回应说,“中国患者与北美患者并不完全相同”,其中包括约14%的HARMONi-A患者仅接受了上一代EGFR抑制剂治疗,而不是HARMONi研究中的第三代药物。
至于西方人群的随访时间较短,West指出,HARMONi的招募速度较慢,部分原因是COVID-19过后试验活动尚未恢复正常。
9月8日的电话会上,Summit CEO Robert Duggan进一步补充道,2023年1月FDA曾破例允许其将中国单区域研究扩展为多区域试验,但北美医生对PD-1/VEGF双抗和中国数据的保守态度,客观上延迟了入组进度。
除了OS,长期随访中,HARMONi和HARMONi-A试验组患者的PFS差异为12个百分点。
在部分业内人士看来,5个百分点以内的差距很容易判断,而5到10个百分点的差距,则会引起一些争论。
支持者认为,HARMONi延续了PFS强阳性结果。一位国际药企统计数据部门前全球领导人告诉同写意,根据目前公开资料,“PFS应该是positive的”。所以,“这个study从统计意义上应该实现相应预设目的”。
简言之,HARMONi研究得到的33% PFS获益本身就相当可观,在肿瘤试验里可视为具有临床意义。5月初步分析记录的48% PFS获益,则意味着该试验确实达到两个主要终点之一。
然而,一些西方分析师觉得,鉴于既往在中国看到的其他III期临床试验结果表现,它们在中国以外有多大的适用性,需要打上一个问号。
West在最新的电话会上回应说,PFS分析显示亚洲与西方的HR高度一致(从0.52变为0.57),mPFS在各区域差异≤0.1个月,北美亚组OS HR是0.70,mOS未达(对照组14.0个月)。这些结果的置信区间高度重叠。
TONACEA
获批概率几何?
如果按照现有资料,FDA会批准依沃西吗?
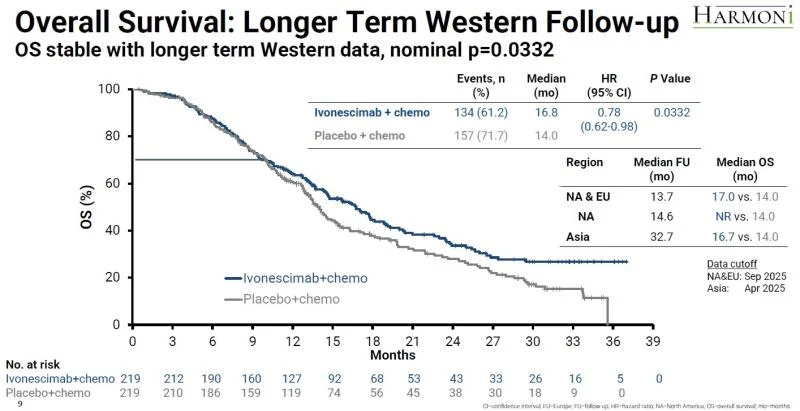
Summit对中国以外人群进行了一项更长期的OS分析,依沃西试验组的死亡风险降低率已扩大至22%,名义p值改善为0.0332。北美和欧洲患者的死亡风险降低率是16%,北美患者为30%,中国患者为24%。然而,前述数据均不具有统计学意义。
相比起来,康方生物不久前的半年报报告披露,中国开展的HARMONi-A在最终分析中取得具有临床意义和统计学显著性的OS获益。
由于HARMONi的中国受试者——占整个试验人群的62%——直接来自HARMONi-A研究,这些受试者此前曾接受第三代EGFR抑制剂治疗失败,故而,此次更长的随访期仅针对西方人群。北美和欧洲患者的中位随访期在更新后为13.7个月,而最终OS分析时为9.2个月。中国患者的中位随访期为32.7个月。
在获批概率上,专家的意见呈现出不小的分歧。
例如,黑永疆就认为,总体上来看数据并没有变差,加上西方人的数据趋势向好,FDA允许其上市的可能性更大些。
“从正面看,PFS达到预设,OS也有改善。从反面看,PFS相差是2.4个月,FDA此前很少批过比差小于3个月的药物,除非OS结果足够好。”不过FDA前审评官,诺思格首席统计师何崑告诉同写意,他仍觉得批准的概率略大于一半。
而按照岸脉生物CMO朱永红的观点,历史上EGFR适应症在欧美的获批基于强PFS结果的并不少见,所以获批不是完全不可能。只不过,目前的大环境是,FDA刚刚强调过OS作为主要终点的重要性。
“个人感觉要看康方和Summit的totality of data package,包括其他试验的初步结果。”朱永红补充说。
8月,FDA发布的《癌症临床试验中总生存期评估新指南草案》明确要求,在可行情况下,OS应作为临床试验的主要终点。即使OS不作为主要终点,药企也必须收集并提交生存数据,以支持药物安全性和疗效的最终评价。
包括依沃西在内的PD-1/VEGF双抗,被认为在FDA此番改革中首当其冲。这类双靶药物理论上可协同提升疗效,然而其临床数据呈现一个尴尬的悖论:PFS数据耀眼,OS尚未“撞线”。
“FDA已经把政策收紧了,强调临床获益的金指标是OS。”烨辉医药创始人华烨分析,“从这次结果来看,OS数据没有达到显著性差别,所以想要获批的难度不小。”
和黄医药CMO石明则认为,临床试验西方人太少,应做全西方人3GTKI,获批希望小于一半。
另外,针对依沃西在北美人群的生存获益数据突出,华烨还提及,注册法规上通常只是将亚组数据作为支持性的次要证据,整体数据质量才是对批准结果影响更重要的砝码。
肖申也对此表示复议。FDA主要看全人群预设分析,而不是事后挑出的亚组。如果整体数据还没达到预设p值门槛,FDA态度会非常谨慎。他指出:“公告中名义p值是0.032,它是否按预先统计计划做了多重性、期中分析校正?如果与方案阈值一致,或经校正仍小于0.0448,那就获批就没问题。”
若是只有北美亚组显著,但整体人群还是边缘显著,肖申分析,FDA可能会要求补充数据,进行长期的随访,或要求做confirmatory trial(可能是上市后III期确认性研究)。部分情况下,尤其获得优先审评或突破性疗法指定,FDA也可能选择有条件批准。
不确定之处在于,FDA一般要求亚组分析必须在统计计划中预先定义,否则很难作为批准的主要依据。而倘若“HR=0.78”来自于后续随访数据,属于事后分析,结果不太会作为批准依据。
由于此次更新的数据截取时间非常近,Summit称,正在与FDA协商最优申报路径,从而确定最终的具体时间表。
TONACEA
出海的“if线”
2022年,康方生物与Summit达成最高总计50亿美元的“联姻”,刷新了当时的创新药出海记录,让业界看到了中国Biotech的风光可能。
但是,随着依沃西去年以来的数次III期临床数据更新,尤其是此番2025年世界肺癌大会上披露的全球HARMONi结果——OS未达到统计学上的显著水平——业界对这段佳话逐渐出现更多不同的解读。
国内一位Biotech CEO对同写意感慨,HARMONi直接纳入国内开展的HARMONi-A研究人群,这样的设计有些过于取巧。通常要开展一项多中心的国际临床试验,入组、对照等条件是统一的,桥接的做法势必带来临床数据的差异波动。
在业界看来,Summit以激进的战略著称,这多少解释了为什么北美受试者的占比为何如此少。
结果就是,尽管在金标准OS上进一步得到提升,却并未达到监管惯例所需要的显著性。
“这提醒我们,在国际临床试验设计上,对于统计分析方案要提前考虑好欧美人群的比重、入组和随访时间,减少回顾性分析存在的假阳性质疑。”前述国内统计学背景审评专家说。
倘若康方生物最初不是选择Summit,而是MNC,结果也许会大不相同。持有这种观点的人,从科伦博泰与默沙东、百利天恒与BMS的合作里找到背书。如此对比并不严谨,但业界的共识却是,MNC国际临床管理能力普遍更高,数据更扎实。
当然,目前为依沃西的国际化之路下定论,似乎还为时尚早。
Duggan透过9月8日的电话会告诉投资者,Summit的核心战略保持不变:持续推进对应市场份额更大的HARMONi-3/7研究,未来数月还会新增两项III期研究,对有利于药物开发的合作持开放态度。
而随着今年以来的MNC涌入,包括辉瑞、默沙东分别从三生制药、礼新医药引进PD-1/VEGF双抗,相信不久的将来,我们可以得到关于本土创新出海更完整的道路图景。
相关新闻





