PD-(L)1江湖,开启技术迭代新赛事
更新时间:
2025-09-29 18:46:28.889

近期,FDA批准了默沙东旗下PD-1抑制剂Keytruda Qlex皮下注射疗法,用于12岁及以上人群,适应症与Keytruda静脉输注制剂已获批的适应症一致。
Keytruda Qlex是由K药(pembrolizumab)和Alteogen开发的透明质酸酶变体berahyaluronidase alfa结合而成的配方,据悉,该剂型的中位注射时间仅需约2分钟。
此次批准是基于临床试验MK-3475A-D77的结果,研究显示,在未经治疗的转移性NSCLC患者中,皮下Keytruda Qlex组和静脉输注Keytruda组的ORR分别为45.4% vs 42.1%;mPFS分别为8.1个月vs 7.8个月,两组的mOS均未达到。
在Keytruda Qlex之前,全球已有三款皮下PD-(L)1药物获批:罗氏阿替利珠单抗(PD-L1)——Tecentriq Hybreza、BMS纳武利尤单抗(PD-1)——Opdivo Qvantm,以及康宁杰瑞/思路迪的恩沃利单抗(PD-L1)。除此之外,恒瑞医药、百济神州、君实生物等PD-(L)1玩家均有对此布局。
除了给药方式的优化外,PD-(L)1的下一步,更是集中在新型药物的迭代上,中国药企在这一方向的进展尤其亮眼。
TONACEA
双抗技术带来新的转折点
早在PD-(L)1抑制剂出现后,研究者们就发现,单药对肿瘤患者的治疗应答率仅在20%左右。
为了突破疗效瓶颈,业界开始探索各种联合方案:PD-(L)1+化疗、PD-(L)1+靶向药物、PD-(L)1+免疫检查点抑制剂等。当这些方案被探索殆尽,双抗技术的崛起,带来了新的转折点。
目前,PD-(L)1/VEGF双抗的研发炙手可热,其中突出代表,是康方生物的依沃西单抗(AK112)。
基于独特的结构,依沃西单抗连接在Fc部分的VEGF scFv,使整个分子对PD-1的亲和力显著增强超18倍,极大提升了对PD-1/PD-L1信号通路的阻断效果,同时PD-1 Fab也使整个分子对VEGF的亲和力增强超4倍,从而强化了对VEGFR信号通路的阻断能力。
在与K药“头对头”的HARMONi-2研究中,针对PD-L1阳性(PD-L1 TPS≥1%)、不伴EGFR突变/ALK重排的晚期NSCLC患者,
依沃西单抗凭借显著的PFS获益击败了K药(11.1个月vs 5.8个月),而且在ORR、DCR上均优于K药。
凭借扎实的临床疗效,依沃西单抗带火了PD-(L)1/VEGF双抗赛道。目前,全球约有超30款PD-(L)1/VEGF双抗处于研发阶段,其中超75%来自中国。默沙东、辉瑞、BMS等MNC更是通过引进中国管线来快速入局这一赛道,体现了肿瘤免疫治疗进化的新方向。
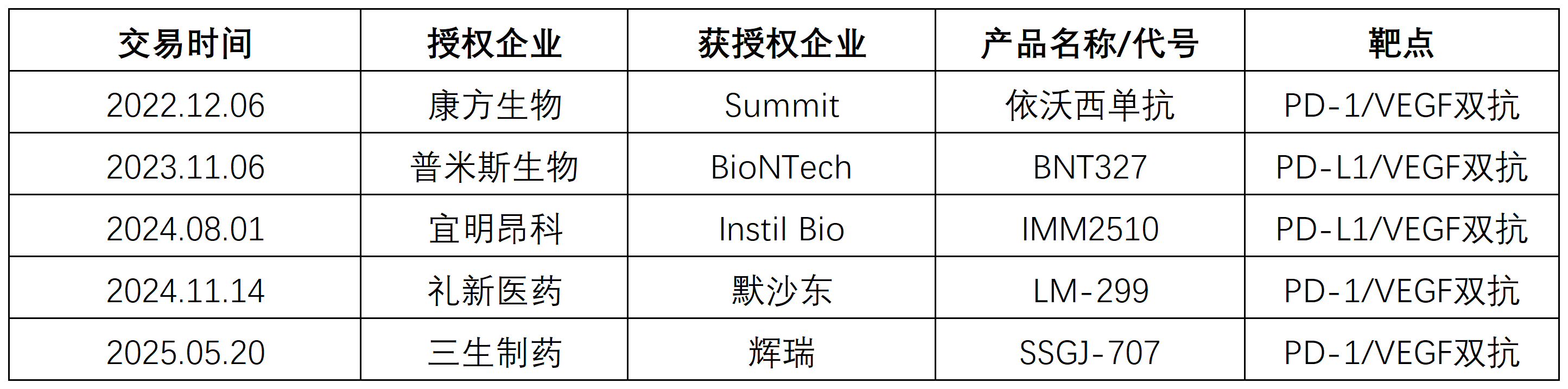
PD-(L)1/VEGF双抗之外,同时靶向4-1BB、TGF-β、CTLA-4的研发也在如火如荼。
例如,4-1BB主要表达于活化的cd8+效应T细胞上,作为T细胞共刺激分子,能够重新激活凋亡的T细胞并大量扩增,减少抗原特异性免疫细胞的清除以及增强免疫记忆方面发挥重要作用。
PD-(L)1/4-1BB双抗既可以阻断PD-(L)1免疫抑制通路,又可以通过4-1BB激活免疫细胞,从而达到解除免疫抑制和激活免疫抗肿瘤的协同效应。
在此布局的维立志博,旗下LBL-024是一款PD-L1/4-1BB双抗。今年ASCO会议上,维立志博公布了LBL-024联合化疗治疗肺外神经内分泌癌(EP-NEC)一线疗法的Ib/II期临床数据。
结果显示,在52例患者中,ORR达到75.0%,DCR高达92.3%;进一步亚组分析显示,泌尿生殖系统NEC、胰腺NEC、SCLC、食管NEC患者ORR分别为100.0%、83.3%、100.0%、77.8%,这一疗效远超传统化疗方案的历史数据(30%-55%)。
维立志博之外,国内天境生物、齐鲁制药、普米斯生物、中国生物制药/F-STAR、信达生物、百奥泰等均有相关动作。

PD-(L)1/TGF-β双抗也是一个比较有潜力的组合。
今年8月,正大天晴的PD-1/TGF-β双功能融合蛋白TQB2868在国内启动了III期研究,这是全球首个进入III期临床阶段的PD-1/TGF-β双抗,适应症为“癌中之王”胰腺癌。
之前的II期临床数据显示,在联合安罗替尼和化疗一线治疗胰腺癌的试验中,中位随访5.9个月时,mPFS和mOS均尚未达到,6个月PFS率和6个月OS率分别为86%和95%。ORR为63.9%(n=36),其中23例患者达到PR,DCR为100%。此外,该联合方案安全耐受性良好。
恒瑞医药的SHR-1701是一款PD-L1/TGF-β双抗,在胃癌一线治疗III期研究中,取得了阳性结果,并已向监管部门递交上市申请。
华东医药则开发了PD-L1/VEGF/TGF-β三靶点抗体融合蛋白DR30206,I期临床结果显示,DR30206具有明确的作用机制和抑制肿瘤生长的作用,且具有良好的安全性。
华东医药之外,国内普米斯生物和启愈生物也布局了PD-L1/VEGF /TGF-β 三靶点靶向药物,目前公开的信息有限。
另外,2025年以来,中国在PD-1/CTLA-4双抗领域迎来爆发式进展。
CTLA-4主要在免疫反应早期(主要在淋巴结中)调节T细胞增殖,而PD-1则在免疫反应后期(主要在外周组织中)抑制T细胞,同时抑制这两个靶点,可以增强免疫治疗疗效。因此PD-1/CTLA-4双抗有望通过机制协同和给药优化,在疗效与安全性之间取得更优平衡。
今年以来,国内康方生物的卡度尼利单抗、齐鲁制药的QL1706等多款PD-1/CTLA-4双抗药物频频迎来利好。
其中,卡度尼利单抗自2025年1月1日起,正式纳入医保;6月,获得NMPA批准,联合含铂化疗±贝伐珠单抗用于持续性、复发性或转移性宫颈癌的一线治疗。
QL1706于今年6月开启了联合贝伐珠单抗一线治疗晚期卵巢透明细胞癌疗效的 III 期临床研究。此前该产品还启动了联合贝伐珠单抗用于肝细胞癌和胃癌的临床研究。
双抗之外,基石药业还开发了PD-L1/VEGF/CTLA-4三抗药物CS2009,今年7月,其全球多中心I/II期临床研究在澳大利亚和中国启动。
TONACEA
下一个关键力量:PD-L1 ADC
就在双抗研发如火如荼的同时,多款新型ADC产品披露了出色的疗效数据,使得PD-(L)1+ADC组合成为如今热点之一。
而创新型PD-L1 ADC药物,自带“IO+ADC双重优势”,成为引领肿瘤免疫治疗变革的下一个关键力量。
复宏汉霖的PD-L1 ADC药物HLX43,在今年ASCO会议上展现了硬实力。
在难治性肿瘤患者中,HLX43在Phase 1a、Phase 1b均显示高ORR且带来PFS获益的趋势。具体来说,Phase 1a的最终ORR为36.8%(n=21),mPFS为4.2个月;Phase 1b中难治性NSCLC患者的ORR为38.1%(n=21),DCR为81%,mPFS为5.4个月。目前,复宏汉霖正在推动HLX43往前线的治疗。
辉瑞的 PD-L1 ADC药物PF-08046054 于今年8月正式启动III期临床试验,成为全球首个迈入III期阶段的PD-L1 ADC。之前研究显示,PF-08046054在1.5mg/kg 剂量下,30例经治NSCLC患者的ORR为 26.7%。
目前押注PD-(L)1 ADC赛道的药企不多,且研发仍处于早期阶段,后续行业动态值得持续关注。
TONACEA
PD-(L)1激动剂,开启新蓝海
PD-(L)1抑制剂改变了肿瘤治疗格局,另一边,免疫检查点的“一体两面”,也使得PD-1激动剂有望剑指自免大蓝海。目前,全球范围内处于临床阶段的PD-1激动剂并不多。
曾经礼来的的PD-1激动剂Peresolimab,一度被给予厚望。
在治疗类风湿关节炎(RA)的临床IIa期研究中,Peresolimab达到了主要终点和部分次要终点,但其ACR50(较基线缓解50%人群比例)和ACR70响应方面并无显著优势,并且安全性存疑,最终礼来终止了该药物的研发。
不过今年3月,AnaptysBio宣布旗下PD-1激动剂Rosnilimab治疗RA的IIb期临床取得成功,公司股价因此大涨30%。期待后续临床结果能继续保持优异的疗效和安全性。
国内金赛药业开发了PD-1激动剂GenSci120,今年1月刚开始临床试验启动,适应症为成人系统性红斑狼疮(SLE)、成人原发性干燥综合征、炎症性肠病和类风湿关节炎。
最终PD-1激动剂能否在自免赛道闯出一条路,我们拭目以待。
PD-(L)1靶点经过多年探索,目前在双抗、ADC、激动剂领域仍然是“历久弥新”。同时PD-(L)1成药性的进阶之路,也是中国创新药产业升级的微观映射。
在新技术开发上,国内部分药企已实现与国际并跑,创新质量实现了显著跃升,期待中国药企在PD-(L)1竞争下半场早日弯道超车。
上一页
相关新闻





