药监局四连批启示:抛弃“平替”角色的“全球首创”中国新药
更新时间:
2025-07-08 08:10:10.786
TONACEA
从ifupinostat看中国创新药崛起的全球化坐标
2025年7月初,中国国家药监局一日内连批四款由本土药企开发的新药,涵盖两款小分子两款抗体药物。这在惯常的新药审批节奏中并不罕见,但本次批准的品种却不容小觑。其中既包括全球首个机制类新药ifupinostat,也有对标国际重磅药的乳腺癌CDK4/6抑制剂tibremciclib,还有突破铂类耐药瓶颈的抗VEGF抗体,以及填补痛风治疗空白的IL-1β生物制剂。
在这些产品背后,我们看到的已不再是“仿制替代”的逻辑,而是机制差异化、适应症先发、全球竞品对接的新路径。它们代表着中国本土生物科技在机制创新、临床设计、患者定位与国际竞争中的多重发力,也让从中国诞生的全球首创药不再只是个例。
TONACEA
Ifupinostat:双靶点的中国式解法,打破“靶点孤岛”
• Ifupinostat获批历程
Ifupinostat(BEBT-908)是由必贝特医药(BeBetter Med)研发的小分子抗肿瘤药物,作用于HDAC(组蛋白脱乙酰酶)和PI3K(磷脂酰肌醇-3-激酶)两个关键通路。在治疗弥漫大B细胞淋巴瘤(DLBCL)中,它成为全球首款获批的HDAC/PI3K双重抑制剂药物。
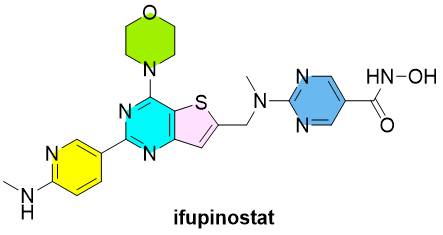
国际上,美国Curis公司曾开发结构相似的fimepinostat,并于2018年获得FDA快速通道认定,但Curis最终将主要精力集中在了另一项B细胞淋巴瘤资产IRAK4抑制剂emavusertib项目上而终止了fimepinostat的开发。ifupinostat则在中国完成了关键性2b期试验,在经过两线以上治疗失败的DLBCL患者中获得33.8%的ORR;如果剔除疫情造成的脱落与偏差,ORR可达53.6%。更值得关注的是,在接受过CAR-T或双抗治疗仍无效的患者中,其ORR达67%,展现出在免疫治疗失败患者群体中的差异化价值。
• Ifupinostat获批意义
相比动辄百万元一疗程的CAR-T治疗,ifupinostat作为口服小分子药物,更具性价比优势,也更容易在医保体系中获得广泛应用。目前该药已进入三期验证性临床,联合利妥昔单抗(rituximab)用于二线DLBCL治疗,早期数据显示ORR达76.2%,在今年ASCO会议上获得关注。
Ifupinostat 的获批意义并不仅在于“首创”这两个字,而在于它对靶点协同策略的首次商业化验证。HDAC 和 PI3K 作为两个独立存在于多种癌症进程中的关键酶靶点,曾长期被认为不易联用:前者影响表观遗传调控,后者主导细胞增殖与存活信号通路,双抑制可能导致毒性增强,亦可能信号互扰。而 ifupinostat 的成功,意味着通过合理分子设计和平衡抑制谱,这一“协同-非冗余”的靶点组合被首次转化为可行的临床药物。
对全球血液瘤药物开发而言,这一里程碑事件无异于打开了非免疫类新机制的另一个入口。在 CAR-T 和双抗主导的当前格局下,小分子产品的空间逐渐被压缩,但 ifupinostat 提供了一个清晰的例证:在免疫疗法失败后的患者中,机制迥异的小分子依然能带来真实的治疗获益。这不仅为 PI3K 研发领域注入新活力,也可能推动其他多靶点协同策略如HDAC/BTK、PI3K/BRD4等组合加速向临床过渡。
而从患者角度看,它更意味着一种可负担、易使用、作用机制不同的选择,尤其是对于那些曾被告知“CAR-T失败后别无选择”的患者而言,ifupinostat给出了一条全新的生路。
TONACEA
Tibremciclib:后发突围的“精调”CDK4/6抑制剂
• Tibremciclib获批经历
乳腺癌领域的CDK4/6抑制剂早已形成全球三巨头格局:辉瑞的Ibrance、诺华的Kisqali、礼来的Verzenio。这类药物通过抑制细胞周期蛋白的活性,延缓HR阳性、HER2阴性乳腺癌的进展。此次由贝达药业 (Betta Pharma) 开发的tibremciclib,作为中国本土第八款同类药物,却并非简单复制。
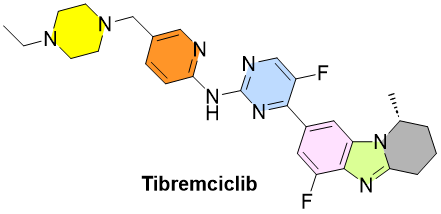
在一项中国III期临床研究中,tibremciclib联合fulvestrant用于激素治疗耐药患者,显著延长无进展生存期(PFS),将疾病进展或死亡风险降低69%。与Verzenio相似,tibremciclib也为可口服制剂,但在分子设计上对CDK9的抑制力更弱,可能减少常见的不良反应,如脱发和造血抑制。
• Tibremciclib获批意义
Tibremciclib 的批准,是对“精调式药物优化”的一次有效示范。CDK4/6 类药物自诞生以来已积累大量数据与经验,但非选择性抑制仍导致一定比例的骨髓抑制、肠道不适等毒副反应,特别是在亚洲女性患者中更为显著。Tibremciclib 通过在结构上降低对CDK9的亲和性,使其在确保肿瘤控制力的同时,可能减少脱发与造血系统毒性。这种选择性提高+耐受性优化的方向,正在成为后CDK4/6时代的国际共识。
其III期数据的强劲表现,不仅巩固了中国本土产品的竞争地位,也为全球CDK4/6领域提供了一个新范例。尤其是在多国CDK4/6研发布局拥挤的当下,tibremciclib若能在亚洲乃至拉美、非洲等市场推进,或可重塑全球此类药物的定价与组合策略。
从患者角度出发,它则带来了延长PFS的可能性,以及一款更适合长期治疗、日常生活影响更低的方案。对于中老年HR+/HER2-女性而言,这种治疗体验的改善尤为重要。
TONACEA
Suvemcitug:重构抗血管生成治疗的卵巢癌版图
• Suvemcitug获批历程
抗VEGF治疗在多个肿瘤中早已被证实有效,Avastin(Bevacizumab)作为老牌抗体药物也被广泛用于卵巢癌。但在铂耐药这一高度未满足的患者群体中,国际上尚未取得明确的突破。由先声药业开发的人源化IgG1型抗VEGF单抗药物suvemcitug,选择从这一人群切入,并在中国开展随机III期临床试验Scores,获得显著成果。
数据显示,suvemcitug联合化疗使患者疾病进展或死亡风险降低54%,并在总生存期方面展现出21%的初步风险降低。这是目前全球首个在“铂耐药卵巢癌”中由双盲RCT支持的抗血管生成治疗证据,为这一人群提供了新的治疗策略,也为中国原创抗体药物拓展全球路径提供了范例。
• Suvemcitug获批意义
Suvemcitug 所代表的,不仅是一种新抗VEGF药物,更是一种高选择性新适应症的临床策略。在铂耐药卵巢癌这一极具挑战的群体中,传统疗法几乎束手无策,且大部分患者属于既往反复治疗后的虚弱体质,对毒性忍耐度更低。suvemcitug 的成功,不仅在于其数据的显著性,更在于它作为国产生物药,首次在一个由国际大厂长期主导的靶点领域打出了差异化临床证据。
其III期Scores研究是首个在该适应症中使用双盲设计的抗血管生成药试验,严格性远高于以往开放标签研究,也为其未来寻求FDA或EMA认可以及跨境许可合作提供了有力基础。
对患者而言,这不仅仅是多一种药,更是从无到有的希望。对于年均OS不足12个月、且治疗选择匮乏的铂耐药卵巢癌患者来说,suvemcitug 不只延长生存,更可能延缓生活质量急剧恶化的过程。
TONACEA
Firsekibart:在痛风治疗中填补“生物制剂空白”
• Firsekibart获批历程
急性痛风发作虽属常见炎性疾病,但对传统药物不耐受或有禁忌者,治疗手段极为有限。Firsekibart由长春金赛药业(Changchun GeneScience Pharmaceutical)开发,是一款靶向IL-1β的人源化单克隆抗体,与诺华的Ilaris机制相同。
2023年Ilaris获得FDA批准用于急性痛风发作,但尚未在中国上市。Firsekibart则率先满足中国患者在生物制剂治疗方面的临床空白。它适用于不能耐受NSAIDs (非甾体抗炎药)、秋水仙碱,且不宜反复用糖皮质激素的特定患者群体,体现出高度精准的患者定位策略。
• Firsekibart获批意义
痛风是一种常见病中的严重病,尤其是在高尿酸人群不断扩大的当下,其急性发作对生活的干扰、对慢病共病(如心血管、糖代谢)的影响正受到临床高度重视。而传统的NSAIDs与秋水仙碱方案,对肾功能不全、老年人群乃至合并用药的患者群体已不再适用。
Firsekibart 的出现,首次将炎症源头阻断引入这一领域。IL-1β 是痛风发作中关节急性炎症的关键因子,其作用远早于症状出现阶段。Firsekibart 的靶向机制,可在症状高峰前介入,从机制上抑制炎症级联反应,真正做到了对因治疗,而非传统解热镇痛的对症处理。
全球市场上,Ilaris 虽已在美国等国获批,但因价格昂贵和适应症局限,且未在更多的国家落地。Firsekibart 不仅为中国本地患者提供了可及选择,也有望以“定价合理+患者精准识别”的优势,在新兴市场建立自己的生态。
TONACEA
中国新药的全球接轨,进入“机制输出”时代
这四款新药的集中批准,并非偶然巧合,而是中国医药产业从结构积累迈向全球输出的一个重要信号。我们正在见证一种转变:中国不再只是追逐国际标准的执行者,而逐步成为临床机制和治疗策略的制定者(表1)。
表1. 中国近期四款获批药物全球对照表
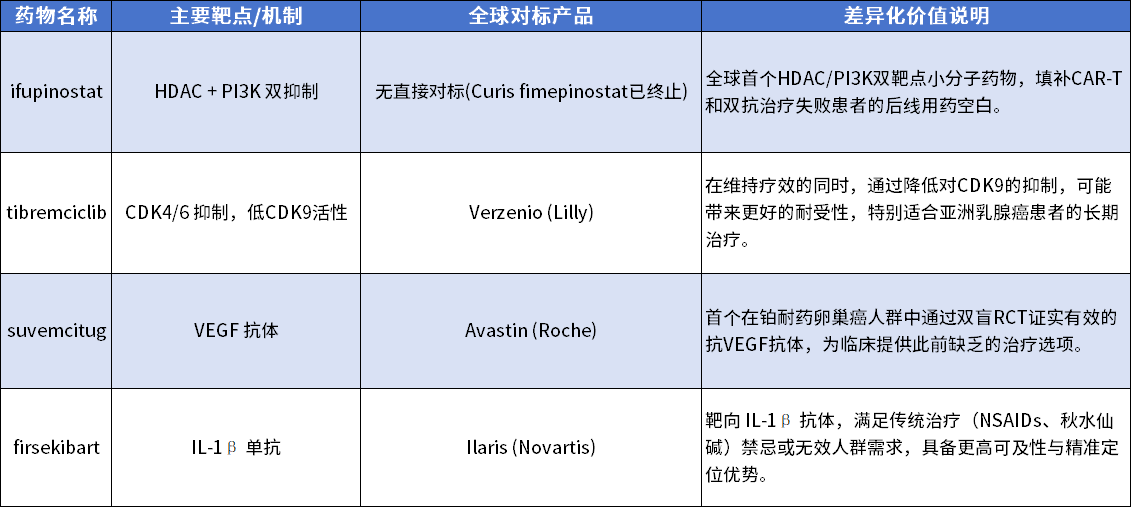
Ifupinostat 不仅开创了全球靶点组合的新局面,也打通了免疫疗法后用药的缺口;tibremciclib 用优化结构向世界证明,创新不必大刀阔斧,也可以精雕细琢;suvemcitug 在铂耐药卵巢癌中所释放出的信号,将推动全球对VEGF类药物的适应症再认知;而 firsekibart,则真正将源头治疗理念带进了一个多年未有突破的常见疾病领域。
这些突破,最终都将回到一个最本质的问题:为患者带来了什么?答案是”选择自由”。是“失败后还有药可选”的局面,是“新药可负担”的解脱。这一切,正在从中国发生,并向世界传递新的答案。
上一页
相关新闻





