PD-(L)1/VEGF双抗:千亿美元市场的研发与专利布局思路
更新时间:
2025-07-30 12:03:43.351

2025年5月20日,三生制药将PD-1/VEGF双抗的中国外全球权益授权给辉瑞,辉瑞支付12.50亿美元预付款,生物医药似乎迎来了行业的Deepseek时刻。
针对PD-(L)1 / VEGF双抗,目前包含三生制药在内的5家中国企业已经实现了出海BD交易,开源证券分析师指出PD-(L)1/VEGF 双抗有望迭代PD-(L)1单抗市场成为下一代IO基石药物,后续与 ADC/TCE 等联用将持续拓宽市场空间,成为千亿美金市场的基石用药[1]。
PD-(L)1 / VEGF 双抗出海BD交易(单位:亿美元)
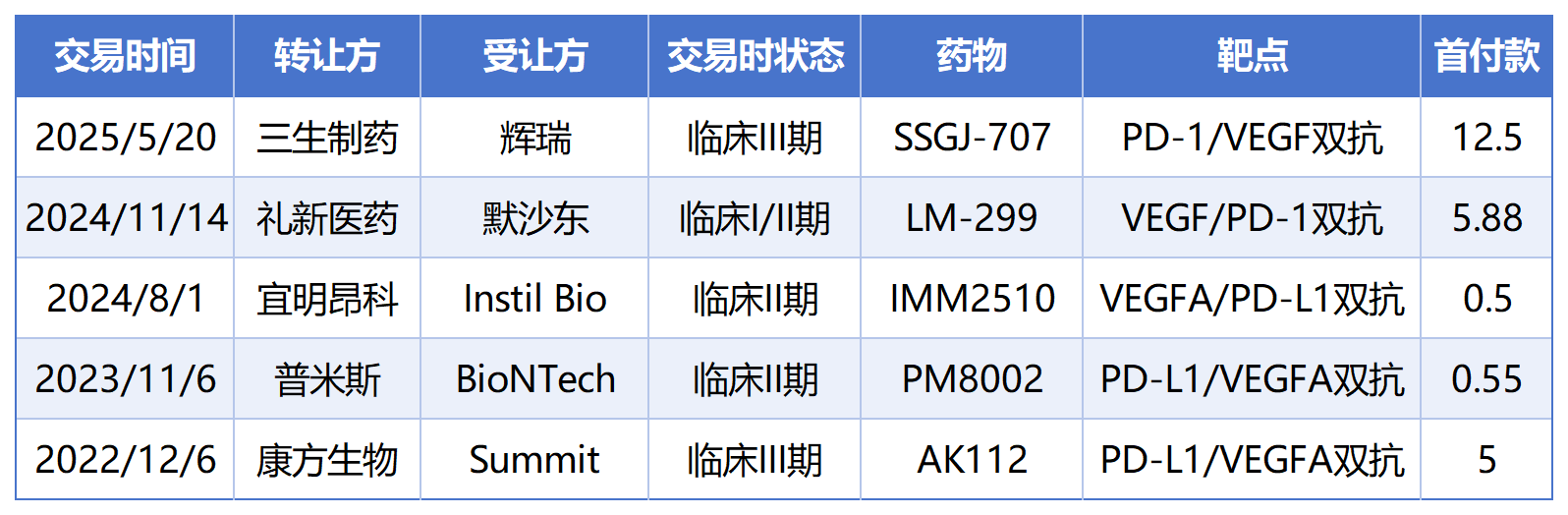
本文梳理了PD-(L)1 / VEGF 双抗产品竞争格局和Format构造,检索并分析相关专利以期能够回溯研发和专利布局构思,为后续双抗开发提供一定借鉴思路。
TONACEA
竞争格局
PD-1 / VEGF竞争格局
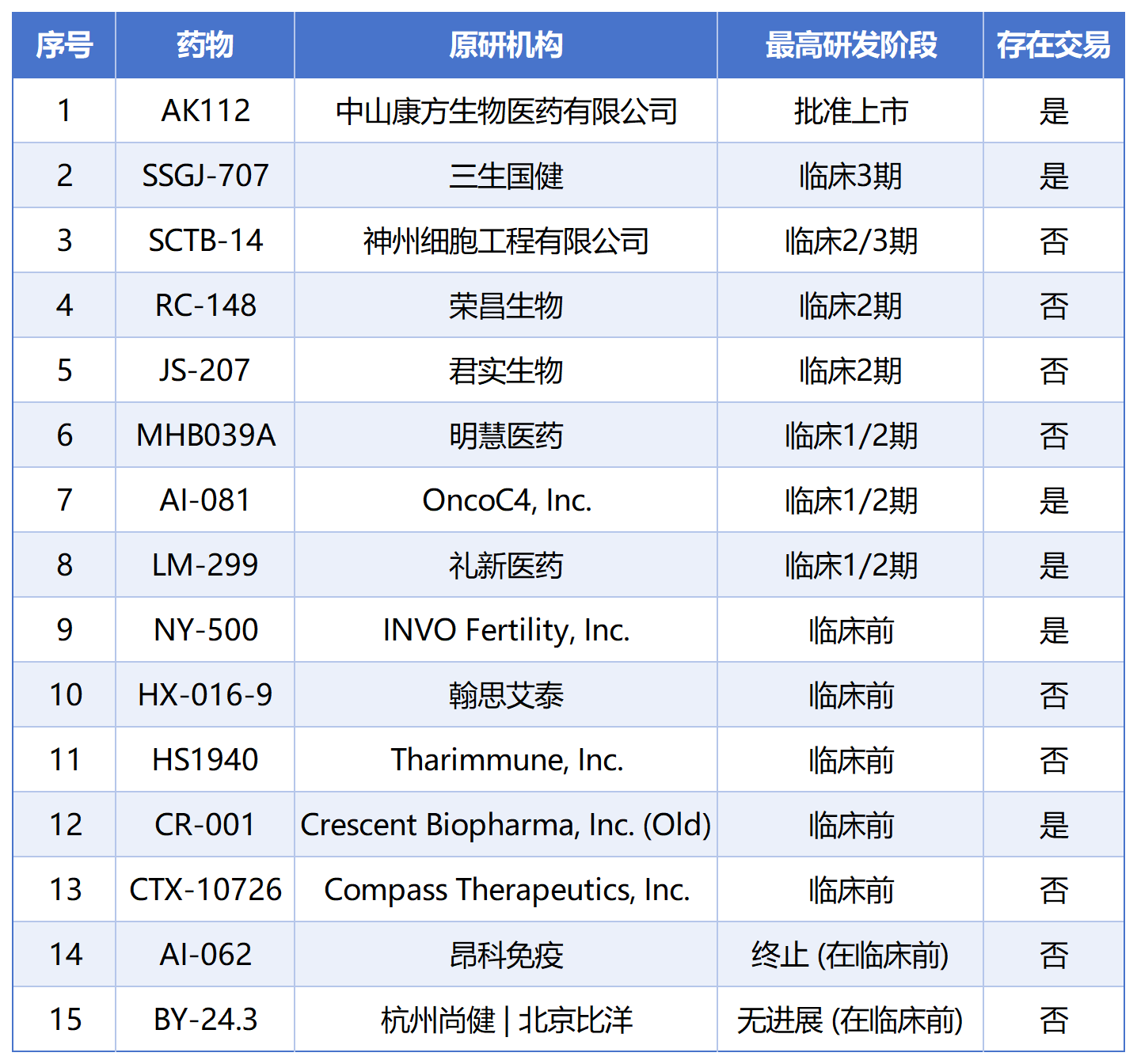
根据智慧芽新药情报数据库,截止至2025/07/23日,PD-1/VEGF双抗15个产品中,8个处于临床阶段,其中康方生物AK112已经在国内批准上市,三生制药SSGJ-707处在临床三期。
PD-L1 / VEGF竞争格局
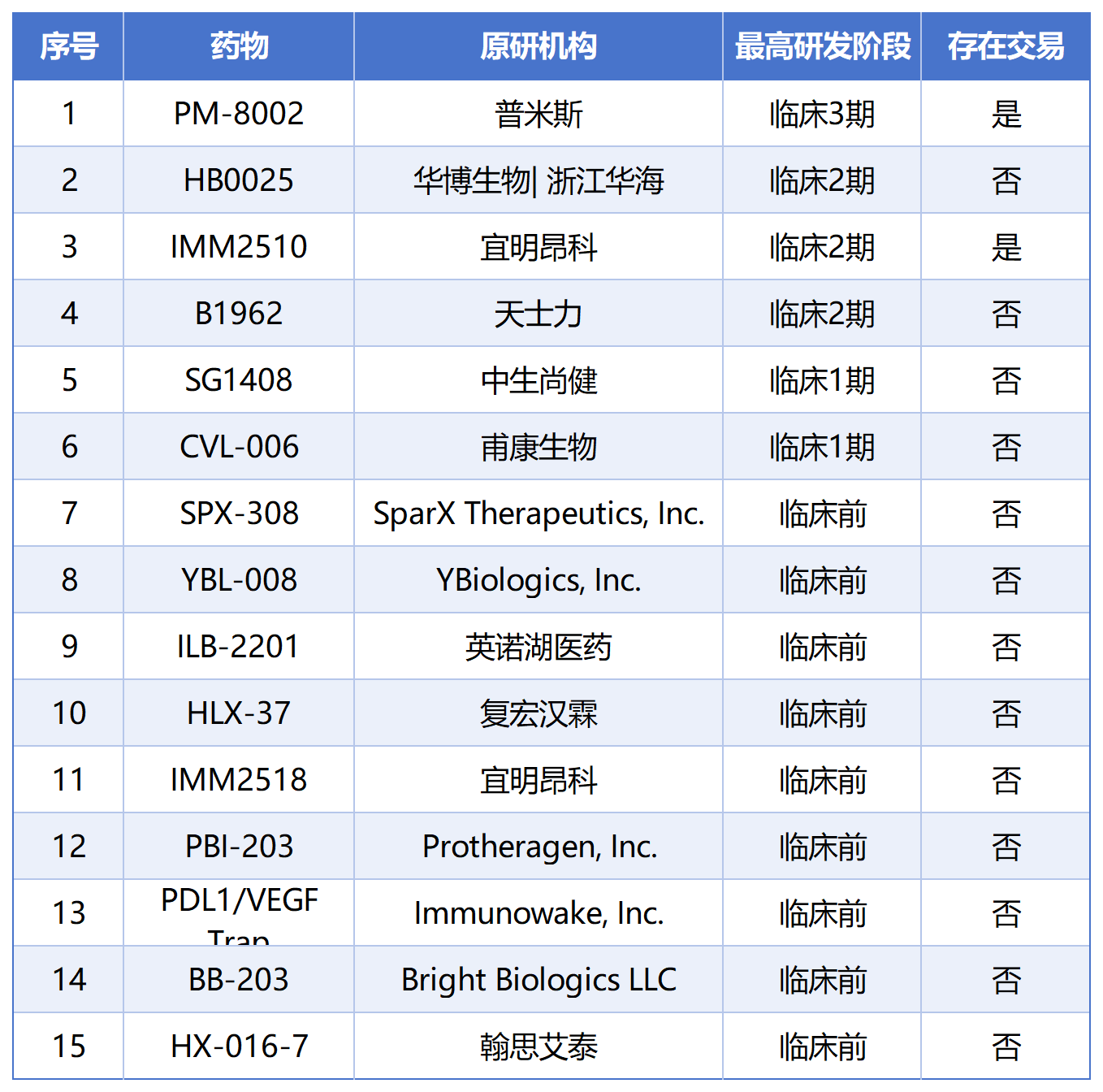
PD-L1/VEGF 15个产品中,其中6个处于临床阶段,普米斯PM-8002进展最快,处在临床三期。
从竞争格局中可以看出,国产创新药企基本主导 了PD-1/VEGF 双抗赛道。
TONACEA
部分产品Format
单抗看靶点,双抗看平台,本文汇总了专利和官网中公开的部分在研PD-(L)1 / VEGF 双抗的可能的Format。总体来看,PD-(L)1 / VEGF大部分都采取了2+2对称结构的分子设计,但各产品又有区别。
PD-1 / VEGF Format
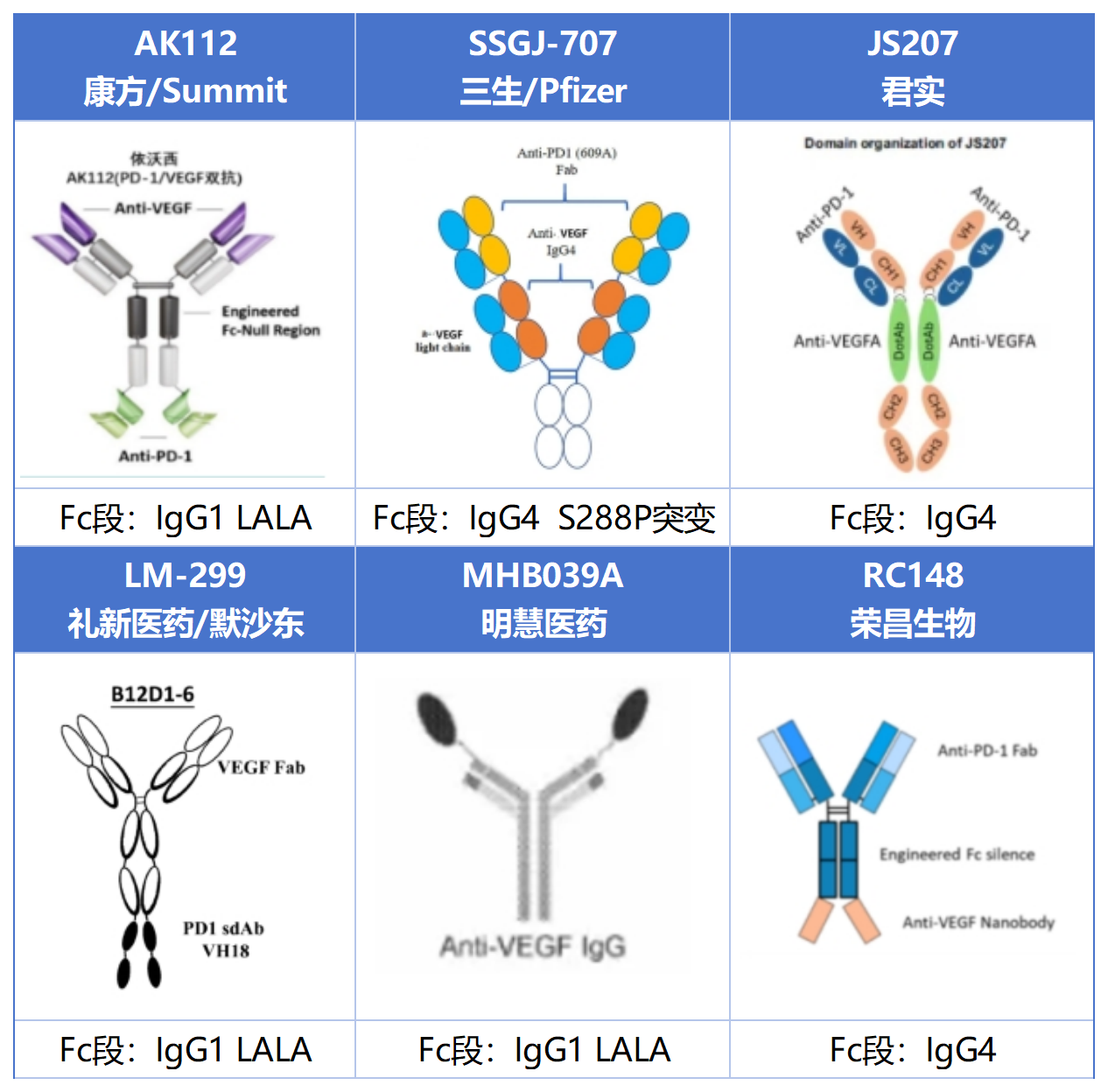
康方、礼新和明慧医药VEGF片段均采用IgG1样结构,区别在于Pd-1部分,康方采用ScFv结构连接在VEGF重链的C端,礼新采用2个Pd-1纳米抗体串联在VEGF重链的C端,明慧医药将Pd-1纳米抗体连接在VEGF重链的N端。
PD-L1 / VEGF Format
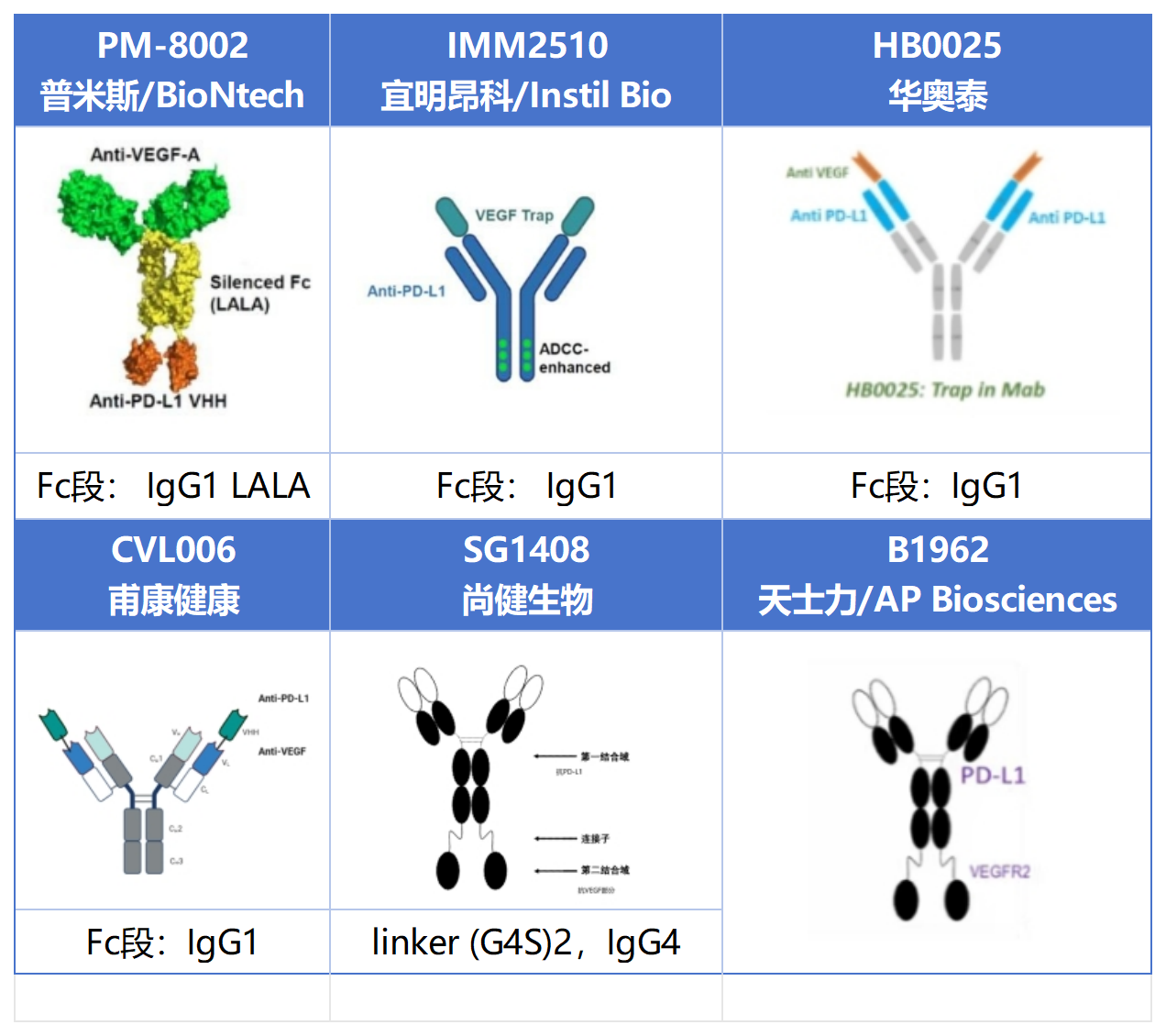
普米斯和甫康采用IgG 1样结构的VEGF片段,区别在于PM-8002将Pd-L1纳米抗体连接在VEGF重链的C端,CVL006将Pd-L1纳米抗体连接在VEGF轻链的N端。宜明昂科、华奥泰、尚健生物和APBiosciences Pd-L1 片段均采用IgG样结构,其中IMM2510与HB0025 Format结构基本类似,且VRGF结合片段均采用VEGFR1D2连接在Pd-L1重链的N端;尚健生物和APBiosciences将VRGF结合片段连接在Pd-L1重链的C端。
TONACEA
PD-(L)1 / VEGF产品研发构思
以原研企业名称为检索要素,结合产品信息进行专利检索,并梳理了部分专利审查过程中引用的部分对比文件,绘制了如下部分产品的专利时间线(以优先权日为准):
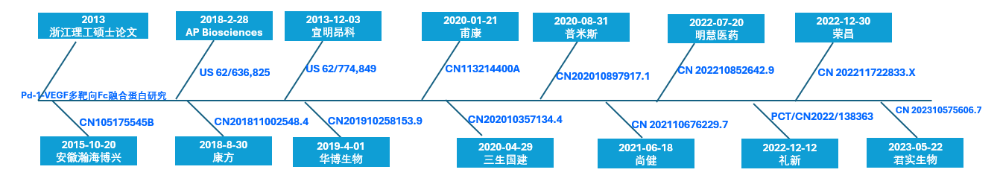
AP Biosciences和安徽瀚海博兴专利申请日期均早于康方生物;荣昌和君实生物申请时间虽较晚,临床速度推进较快。
进一步分析专利中双抗分子片段来源及双抗分子设计筛选思路,统计如下:
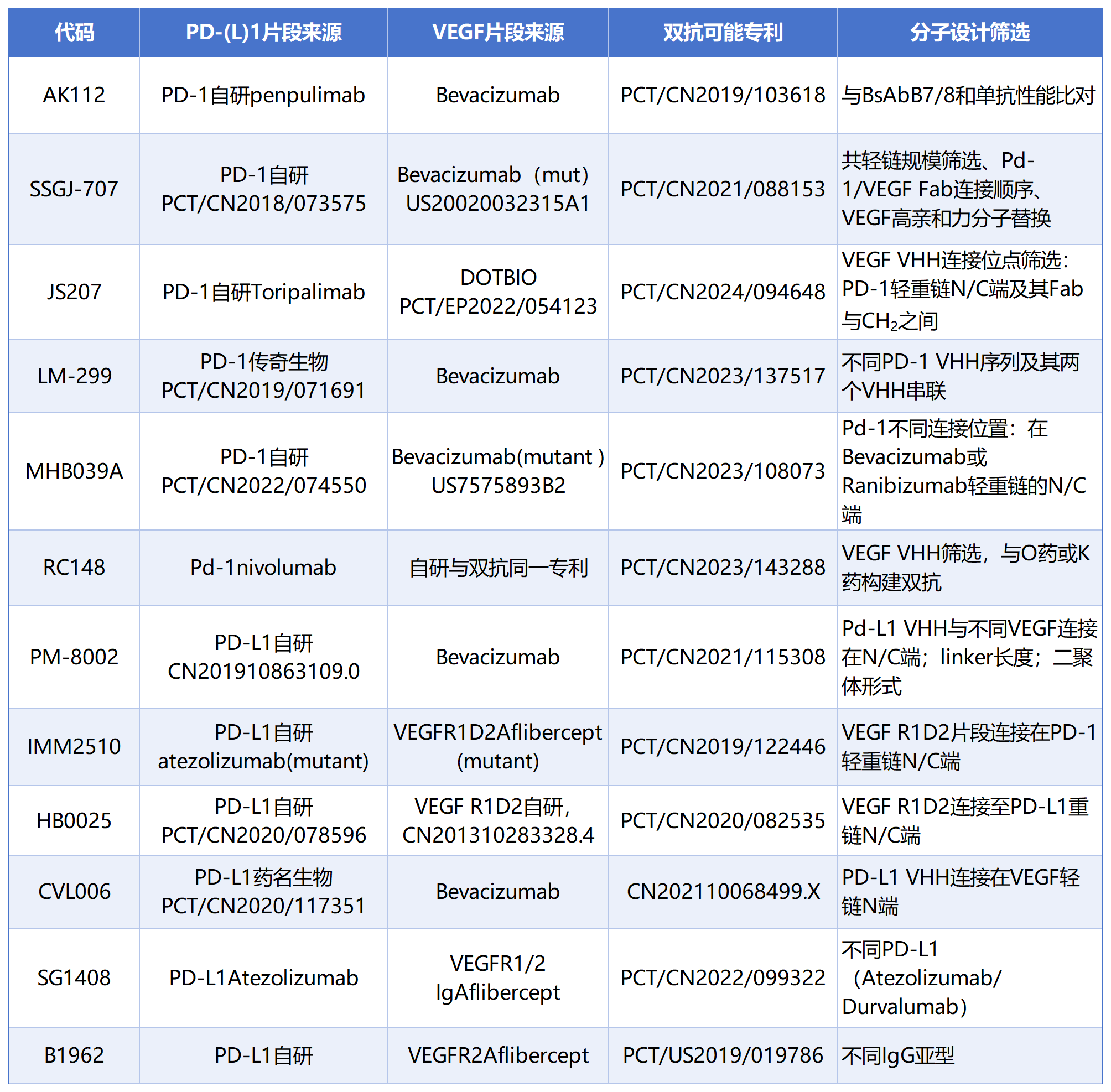
注:PD-(L)1片段来源或VEGF片段来源是指抗原结合片段序列部分或全部来源于表中产品;因部分产品未公开相关信息,代码和专利不能保证完全对应。
01
PD-(L)1 / VEGF中PD-(L)1结合片段来源
在构建双抗过程中,PD-(L)1抗原结合片段来源于以下四种途径:
1)企业前期成药管线:如AK112中采用当时临床在研的Pd-1 penpulimab(派安普利单抗注射液)、JS207中采用已上市的Toripalimab(特瑞普利单抗注射液);
2)第三方上市药物片段或改进:如RC148中采用nivolumab ,IMM2510和SG1408中采用Atezolizumab或其改进片段;
3)单独自研:如SSGJ-707、MHB039A、PM-8002、HB0025、B1962所用PD-(L)1结合片段为单独自研;
4)外部授权许可:例如LM-299中PD-1来自于传奇生物,CVL006来自药名生物Pd-L1纳米抗体;南京蓬勃生物基于传奇生物的Pd-1纳米抗体专利从礼新医药LM-299对外授权中获得2.35亿美元提成。
02
PD-(L)1 / VEGF中VEGF结合片段来源
关于VEGF结合片段选择相对单一,大部分采用Bevacizumab、Aflibercept的特定结构域或其突变的片段,也有少部分外部授权许可(如JS207双抗中VEGF VHH片段来源于DOTBIO)或自研(HB0025和RC148中VEGF结合片段)。
03
双抗分子设计筛选
在确定片段分子序列后,专利中大都进行了不同连接方式、位置和linker的探索,构建不同Format结构。
仅从专利记载内容分析,除三生进行了大规模序列和连接方式筛选外,其它企业在构建双抗时少有对双抗序列规模化筛选。
TONACEA
PD-(L)1 / VEGF专利布局
从第三部分可以看出,PD-(L)1 / VEGF靶点至少在2013年硕士论文或2015年安徽瀚海博兴专利中公开,所以后期实际临床药物均无法从靶点上获得专利保护,仅能保护特定的分子。双抗的构建过程中,使用的靶向PD-(L)1和/或VEGF的结合片段序列在双抗专利申请时可能为现有序列;叠加中美欧专利审查标准不同,所以不同情形的专利布局策略也不相同。
01
PD-(L)1和VEGF片段均为现有技术
AK112、SSGJ-707、JS207和LM-299构建双抗时,靶向PD-(L)1和VEGF的结合片段序列均为现有技术,这种组合形成的双抗专利,试验效果数据要求相对较高。
目前AK112和SSGJ-707在中美欧专利均已经授权,其中SSGJ-707采取了首先快速拿到双抗全长序列(最小保护范围)的思路,后续通过分案或接续案策略拿到更大保护范围,可能与其配合BD策略有关。
AK112在中国CN 109053895 B审查过程中,OA审查意见中指出由于双抗使用的PD-1和VEGF片段CDR序列已经公开;虽然相比于母抗,双抗在三个方面获得了不错的技术效果;但指出需要与最接近现有技术(安徽瀚海博兴)公开的双抗相比,具有意料不到技术效果;该部分数据未记载在CN 109053895 B中,但记载在了在后的PCT中,最终陈述认可了其创造性,但限定了Format结构。
在欧洲同族专利EP3882275B答复时,虽然未采取安徽瀚海博兴专利作为对比文件,但审查员认可了基于相比于母抗的有益效果可以作为意料不到技术效果、从而支持创造性。
JS207和LM-299进行试验设计时,双抗不仅与母抗进行了比对,而且与AK112进行了性能比对,这将为后续专利创造性答复提供依据。
02
PD-(L)1或VEGF结合片段其中一个为现有技术
MHB039A、RC148、PM-8002、IMM2510和HB0025中,PD-(L)1或VEGF结合片段其中一个为现有技术。
明慧医药MHB039A在前期自研PD-1未公开前递交了对应双抗,使自研Pd-1片段不构成双抗的现有技术;在专利中与O药和Bevacizumab对照,未与现有双抗进行性能比对,目前专利在审查过程中。
普米斯PM-8002在自研PD-L1纳米抗体公开前,递交了双抗,同样仅在双抗专利中体现了与母抗的比对,并未与任何双抗进行比对;目前中美专利均已经授权,欧洲专利在审查过程中。
HB0025也是在自研Pd-L1专利公开前,递交了双抗申请,同时在专利中记载了与母抗比对试验,但无双抗比对试验。目前中美专利均已经授权,在欧洲专利审查阶段,进一步补充了双抗与母抗Combo的联合比对试验,证明其创造性并得到了认可。
荣昌生物双抗专利则与VEGF VHH在同一专利中,并且进行了大量比对,包括和母抗/母抗Combo/现有双抗;目前专利在审查中,显然这些比对数据,除了药物研发本身探索外,在试验设计时考虑了后期专利审查创造性的答复。
03
专利无效
随着中国创新能力的不断增强,中国创新主体逐渐由之前的无效请求人转变为了创新药专利权人。
欲戴王冠,必承其重。康方生物作为PD-(L)1 / VEGF 赛道的先行者, 第三方在2025年06月18日采取稻草人方式对其欧洲专利EP3882275B提起了异议,异议请求中引用安徽瀚海的专利作为对比文件否定AK112的创造性。
同时指出由于AK112 欧洲专利记载的与安徽瀚海双抗的比对数据未在优先权中记载,该部分不享受优先权,且优先权专利在PCT正式前已经公开(优先权专利ZL201811002548.4在中国选择了提前公开),将优先权专利作为对比文件用来否定欧洲专利。
康方生物需要针对该异议请求在4个月内做出答复,目前中美欧专利授权范围欧洲最大,不排除未来康方生物对保护范围进行部分限缩。
另外,国知局网站显示康方生物在2025年06月18日完成了对安徽瀚海的相关专利(CN201510692484.5和CN201910734971 .1)的受让,笔者认为可能由于相关专利保护分子与AK112分子相似,避免后续竞争。
TONACEA
启示
01
研发角度
多特异性抗体(如双抗)开发区别于单抗,分子构建大多类似搭积木的模块化组合,可从多种途径(如前期自身管线、第三方专利过期或即将过期分子、授权许可、单独自研)寻求所需的积木块,采取不同拼接位点和linker快速形成所需多特异性抗体进行功能性测试。
02
专利角度
首先,若针对某一抗原结合片段有单独序列上的改进,通常对该序列寻求单独保护,且在该专利公开前递交相应的双抗序列专利。
其次,关于比对试验数据,由于构建多特异性抗体(如双抗)时,往往某一抗原结合片段序列为已知序列,或者所有抗原结合片段序列均为已知序列,在进行实验设计时,通常需要与母抗进行比对,证实构建的多特异性抗体相比于母抗原有功能有提升;并尽可能多挖掘有利数据,例如与现有技术中的相关多特异性抗体和/或母抗Combo相比功能提升的数据,以便后期专利创造性方面的答复, 这在PCT/CN2023/143288有很好的示例。
EP3882275B异议中,无效请求人也分别以单抗、单抗Combo和双抗三个角度作为最接近的现有技术,以期无效该专利。所以如果序列上无改进,仅组合构成双抗,前期数据挖掘将对专利的授权和稳定有较大帮助。
再次,对于优先权专利,无论后续是否补充完善数据,建议不选择提前公开;避免优先权的提前公开,成为正式申请的授权障碍。
下一页
相关新闻





